| formule structurelle | ||||||||
|---|---|---|---|---|---|---|---|---|
| Aucune formule structurelle disponible | ||||||||
| Général | ||||||||
| Nom | hydroxyde d'ammonium | |||||||
| Autres noms | ||||||||
| Formule moléculaire | NH4 Oh | |||||||
| Numéro CAS | 1336-21-6 | |||||||
| Brève description | liquide piquant incolore | |||||||
| Propriétés | ||||||||
| Masse molaire | 35,1 g mol | |||||||
| État de la matière | liquide | |||||||
| Densité | 0,91 g·cm (25 %) 0,88 g·cm (32 %) | |||||||
| Point de fusion | −57,5 °C (25 %) −91,5 °C (32 %) | |||||||
| Point d'ébullition | 37,7 °C (25 %) 24,7 °C (32 %) | |||||||
| Pression de vapeur | ||||||||
| Solubilité | ||||||||
| Consignes de sécurité | ||||||||
| ||||||||
| MAK | ||||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | ||||||||
Hydroxyde d'ammonium , également solution d'ammoniaque ou eau ammoniaquée , en langage de laboratoire aussi seulement z. B. Ammoniac à 25 % appelé, est principalement une solution physique d'ammoniac (NH3 ) dans l'eau (H2 O), dans lequel se produit une protolyse partielle de l'eau en ammoniac, et qui est donc basique. Le nom hydroxyde d'ammonium suggère qu'il s'agit d'une substance isolable, mais ce n'est pas possible. Par conséquent, cette désignation n'est en fait pas tout à fait correcte, mais elle est toujours utilisée car elle caractérise le comportement de la substance. À la concentration la plus élevée, l'eau ammoniaquée a une densité de 0,880 g/cm³ (=32 % ≙ 620 l NH3 dans 1L H2 O).
L'étiquette de l'additif alimentaire est E 527.
Genèse
Si l'ammoniac (NH3 ) dans l'eau (H2 O) est dissous, les molécules d'ammoniac (qui sont construites dans l'eau du système de liaisons hydrogène polymère et sont donc physiquement dissoutes) interceptent les protons individuels produits par l'autoprotolyse de l'eau :
-
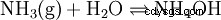 .
.
La plupart des molécules nouvellement formées réagissent, de sorte que la majeure partie de l'ammoniac dissous reste sous forme de NH3 , et non comme NH4 existe.
Propriétés
Les solutions d'hydroxyde d'ammonium contiennent généralement une proportion importante d'ammoniac, qui, physiquement dissous, c'est-à-dire mélangé à l'eau, s'évapore de la même manière que l'eau, en raison de la pression de vapeur plus élevée également beaucoup plus rapidement, c'est pourquoi la concentration d'ammoniac dans les récipients ouverts diminue avec le temps. L'odeur typique, piquante et réglissée de l'ammoniac se produit. B. analogue de conc. l'acide chlorhydrique s'évapore, formant une fumée blanche dense de chlorure d'ammonium dans une réaction acide-base non aqueuse.
Dans les expériences à basse température, un composé d'addition (NH3 H2 O) peut être isolé, qui fond à -77 ° C. Cependant, ce n'est pas l'hydroxyde d'ammonium proprement dit, mais plutôt des cristaux d'ammoniac avec de l'eau attachée.
Consignes de sécurité
Les données d'étiquetage du tableau se réfèrent à la solution concentrée (=32 %). L'UE a défini les classifications suivantes pour les autres plages de concentration :
| C ≥ 25 % | C,N | R :34-50 |
| 10 % ≤ C <25 % | C | R:34 |
| 5 % ≤ C <10 % | XI | R :36/37/38 |
Historique
On dit que Salmiac était connu des anciens Égyptiens et a été postulé pour la première fois par Arrhenius pour son succès dans la description des bases.
Utilisation
L'ammoniac liquide est utilisé comme remède maison pour nettoyer les surfaces dans la maison, mais c'est aussi un conseil d'initié pour repousser les guêpes. A cet effet, un peu d'ammoniac liquide est mis dans un petit bol dans des pièces fermées, les guêpes éviteront désormais la pièce à cause de l'odeur. À l'extérieur d'un bâtiment, prenez des serviettes en papier imbibées d'ammoniac et étalez-les près du nid de guêpes.
Il est également recommandé de l'utiliser pour nettoyer et lutter contre la croissance de moisissures légères à modérées sur les murs.
Un autre domaine d'application est la lutte contre les ravageurs tels que les lépismes argentés.
Dangers
Les solutions d'hydroxyde d'ammonium contenant plus de 10 % d'ammoniaque sont corrosives. Une inhalation prolongée peut provoquer une impuissance, par ex. B. dans la fumée de tabac des cigarettes.
L'ingestion d'eau ammoniaquée provoque des douleurs intenses, un catarrhe gastrique, des vomissements sanglants, des lésions pulmonaires et vocales, qui ont souvent une issue fatale. Il agresse aussi les yeux.
Étant donné que l'ammoniac est le principal produit d'évaporation, les dangers de cette substance s'appliquent également aux vapeurs d'ammoniac.


