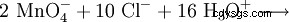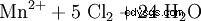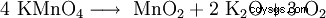| fórmula estructural | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| General | |||||||||
| Nombre | Permanganato de potasio | ||||||||
| Otros nombres | Tetraoxomanganato de potasio (VII), manganato de potasio (VII), permanganato de potasio (um) | ||||||||
| Fórmula molecular | KMnO4 | ||||||||
| Número CAS | 7722-64-7 | ||||||||
| Breve descripción | cristales de color violeta oscuro con brillo metálico | ||||||||
| Propiedades | |||||||||
| Masa molar | 158,03 g mol | ||||||||
| Estado de la materia | arreglado | ||||||||
| Densidad | 2,70 g·cm | ||||||||
| Punto de fusión | Descomposición por encima de 240 °C | ||||||||
| Punto de ebullición | No aplicable | ||||||||
| Presión de vapor | 0,01 mbar (a 20 °C) | ||||||||
| Solubilidad | moderada en agua (64 g/L a 20 °C) | ||||||||
| Instrucciones de seguridad | |||||||||
| |||||||||
| MAC | 0,5 mg·m | ||||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||||
Permanganato de potasio (KMnO4 ) es la sal de potasio del ácido permangánico, HMnO4, que se desconoce en estado libre . Es un sólido cristalino de brillo metálico de color rojo violeta intenso y un oxidante fuerte. El anión permanganato es el único responsable del intenso color de la sal. Se debe a la formación de un complejo de transferencia de carga. En los permanganatos, el manganeso se encuentra en su estado de oxidación más alto, VII.
Propiedades
El permanganato de potasio forma cristales brillantes de color rojo violeta oscuro que son moderadamente solubles en agua y producen una solución de color violeta intenso incluso en bajas concentraciones. Cuando se calientan, los cristales no se derriten, sino que se desintegran con un crujido perceptible, liberando oxígeno. El permanganato de potasio cristalino es estable a temperatura ambiente, pero sus soluciones acuosas se degradan con el tiempo.
Dado que el manganeso está presente en su estado de oxidación más alto en el anión permanganato, se presenta como un agente oxidante muy fuerte en las reacciones redox. Por ejemplo, el permanganato de potasio oxida el ácido clorhídrico a cloro gaseoso (método de laboratorio para la preparación de cloro):
Además, oxida, por ejemplo, sulfitos a sulfatos, Fe(II) a iones Fe(III), alcoholes a ácidos carboxílicos. También puede causar la descomposición de [[Química orgánica|orgánica] sustancias. El permanganato de potasio es oxidante.
El permanganato de potasio se descompone a partir de 240 °C en dióxido de manganeso (MnO2 ), óxido de potasio (K2 O) y oxígeno (O2 ):
Como complejo con éteres corona, el permanganato de potasio también puede estar disponible en disolventes orgánicos no polares como el benceno o el tolueno, que se explota en la química orgánica sintética.
Fabricación
La producción técnica parte del dióxido de manganeso MnO2 con hidróxido de potasio y oxígeno atmosférico para formar el manganato de potasio de color verde (VI) K2 MnO4 reaccionó. Este se procesa electroquímicamente para formar permanganato de potasio (oxidación anódica) y se vende en forma cristalina.
Uso
Debido a su fuerte efecto oxidante, el permanganato de potasio se utiliza, entre otras cosas, como desinfectante, desodorante y algicida. En el análisis químico cuantitativo (oxidimetría, manganometría, valoración redox) se utiliza para determinar un gran número de sustancias (por ejemplo, hierro, nitrito, oxalato e indirectamente también calcio); aquí el punto final de la determinación está indicado por el color violeta. En el laboratorio, la solución de permanganato de potasio alcalino también se usa para limpiar cristalería. En fotografía, se utiliza para detectar la sal fijadora (tiosulfato de sodio) y para reducir las imágenes sobreexpuestas; esto oxida la plata.
Cuando se deja caer glicerina sobre un exceso de sal, la mezcla se enciende después de unos segundos o minutos y arde con una llama violeta característica. Esta reacción retardada se utilizó para iniciar reacciones de termita debido al intenso calor.
Medicina
En medicina, la solución de permanganato de potasio se usa como astringente y desinfectante para el tratamiento externo de la piel, p. para el pie de atleta o la dermatitis del pañal (código ATC D08AX06). En Toxicología de Emergencia, burdeos La solución de permanganato de potasio (aprox. 0,1 %) se utiliza para el lavado gástrico en caso de intoxicación tras la ingestión de toxinas oxidables.
Histórico
Los fotógrafos del pasado usaban permanganato de potasio como componente de los polvos de destello. El permanganato de potasio se usaba para hacer gárgaras con dolor de garganta y en la cocina para desodorizar la carne rancia y hacerla comestible nuevamente.
Instrucciones de seguridad
El permanganato de potasio tiene una clase de peligro para el agua 3 (altamente peligroso para el agua), que, además de su efecto oxidante, debe tenerse en cuenta al eliminar los residuos de permanganato. El permanganato de potasio tiene una toxicidad aguda baja (LD50 (rata, oral) =750 mg/kg), pero tiene un efecto irritante pronunciado en el tejido vivo debido a su fuerte efecto oxidante, por lo que es fácil que se produzcan quemaduras químicas. ¡Por lo tanto, debe evitarse cualquier contacto que no sea el uso médico o incluso la ingesta oral! El polvo de permanganato provoca la opacidad de la córnea.
Sin embargo, la decoloración de la propia piel, que se produce al contacto, es inofensiva y está provocada por el dióxido de manganeso formado durante la reducción del permanganato. Las áreas descoloridas más grandes se pueden decolorar nuevamente con soluciones de sulfito.
Como resultado de su fuerte efecto oxidante, el permanganato de potasio reacciona violentamente con muchas sustancias reductoras o combustibles y puede ocurrir la autoignición. Las mezclas con tales sustancias que no dan lugar a una reacción espontánea son extremadamente inflamables y pueden reaccionar de forma explosiva.
Fuentes
- ↑ Entrada para CAS no. 6487-48-5 en la base de datos de sustancias GESTIS de la BGIA, recuperada el 15 de diciembre de 2007 (Se requiere JavaScript)
- ↑ Roth, Daunderer, Kormann:Plantas tóxicas - toxinas vegetales, ecomed Landsberg, 1988, ISBN 3-609-64810-4 , página 810ff