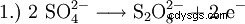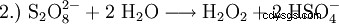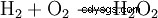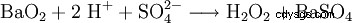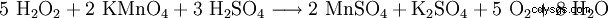| fórmula estructural | ||||||||
|---|---|---|---|---|---|---|---|---|
| General | ||||||||
| Nombre | Peróxido de hidrógeno | |||||||
| Otros nombres | μ-1κO,2κO'-dioxidedihydrogen, perhydrol, peróxido de hidrógeno (obsoleto) | |||||||
| Fórmula molecular | H2 O2 | |||||||
| Número CAS | 7722-84-1 (solución acuosa) | |||||||
| Breve descripción | líquido incoloro | |||||||
| Propiedades | ||||||||
| Masa molar | 34,02 g mol | |||||||
| Estado de la materia | líquido | |||||||
| Densidad | 1,45 g cm (20 °C, puro) 1,11 g cm (20 °C, 30 %) | |||||||
| Punto de fusión | −0,41 °C (puro) −33 °C (35 %) −11 °C (90 %) | |||||||
| Punto de ebullición | 150,2 °C (puro) 108 °C (35 %) 142 °C (90 %, con descomposición) | |||||||
| Presión de vapor | 1,9 hPa (20 °C) | |||||||
| Solubilidad | completamente miscible con agua | |||||||
| Instrucciones de seguridad | ||||||||
| ||||||||
| MAC | 0,5 ml m o 0,71 mg m | |||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | ||||||||
Peróxido de hidrógeno (H2 O2 ) es un compuesto líquido de hidrógeno y oxígeno de color azul pálido, en gran medida estable, incoloro en forma diluida. Es un poco más viscoso que el agua, un ácido débil y un agente oxidante muy fuerte para la mayoría de las sustancias, que como tal reacciona violentamente con sustancias como p. B. el cobre, el latón y el yoduro de potasio reaccionan y, por lo tanto, actúan como un fuerte blanqueador y desinfectante. En una forma altamente concentrada, se puede utilizar tanto como propulsor de cohetes único como componente.
Propiedades físicas
El H2 O2 -La molécula está doblada (ángulo diedro =111°). El peróxido de hidrógeno puro es muy viscoso debido a la fuerte reticulación a través de enlaces de hidrógeno. Dado que el H2 altamente concentrado (=casi anhidro) O2 inestable y se descompone espontáneamente en una explosión, especialmente cuando entra en contacto con metales, normalmente se vende sin receta como una solución máxima al 35% en agua. Para necesidades industriales, sin embargo, también hay concentraciones de 50% H2 O2 en agua.
El contacto con más del 20 % de solución de peróxido de hidrógeno puede causar quemaduras químicas. Por lo tanto, se deben usar guantes protectores durante la manipulación.
Fabricación
En el pasado, el peróxido de hidrógeno se producía principalmente por electrólisis del ácido sulfúrico. Esto forma ácido peroxodisulfúrico, que luego se hidroliza de nuevo a ácido sulfúrico y peróxido de hidrógeno.
Hoy en día, el peróxido de hidrógeno se produce técnicamente mediante el proceso de antraquinona. Para este propósito, la antrahidroquinona se hace reaccionar con oxígeno atmosférico bajo presión para formar peróxido de hidrógeno y antraquinona. En el siguiente paso, la antraquinona se puede reducir nuevamente con hidrógeno a antrahidroquinona, etc. La ecuación general es:
A escala de laboratorio, el peróxido de hidrógeno también se produce en el tratamiento de peróxidos con ácidos. Un reactivo históricamente importante es el peróxido de bario, que reacciona en una solución de ácido sulfúrico para formar peróxido de hidrógeno y sulfato de bario.
Las entalpías molares de formación son:
- Δf Hgas :−136,11 kJ/mol
- Δf Hlíquido :−188 kJ/mol
- Δf Hsol :−200 kJ/mol
Propiedades químicas
El peróxido de hidrógeno tiende a descomponerse en agua y oxígeno. Esto libera energía de 98,02 kJ/mol:
-
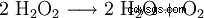
- Desproporción de dos moléculas de peróxido de hidrógeno en agua y oxígeno.
Esta reacción de descomposición es catalizada, entre otras cosas, por Mn (ver prueba) u otros iones de metales pesados, iones I y OH. Por lo tanto H2 O2 - Las soluciones disponibles comercialmente se mezclan con estabilizadores (incluido el ácido fosfórico). Es un agente oxidante fuerte. Cuando el estado de oxidación se reduce de -I a -II, solo se forman agua y oxígeno como productos de reacción. No existen subproductos de difícil separación o disruptivos, lo que simplifica su uso en el laboratorio.
También puede actuar como agente reductor contra agentes oxidantes más fuertes (p. ej., permanganato de potasio).
El peróxido de hidrógeno es un ácido muy débil; sus sales inorgánicas y ésteres orgánicos son los hidroperóxidos y peróxidos.
Prueba
Para la detección cualitativa, los iones Mn (p. ej., MnSO4 ) admitió. Si se desarrolla gas, se usa la prueba del chip ardiendo sin llama para comprobar si hay oxígeno. Si esto resulta ser positivo, en el sentido de que el chip incandescente brilla, H2 fue O2 presente.
- Detección como peróxido de cromo (CrO(O2 )2 )
Hacer del ensayo del festival. Trióxido de cromo CrO3 con peróxido de hidrógeno en el rango fuertemente ácido (pH <0) da como resultado el peróxido de cromo de color azul intenso, que se disuelve en éter. Para ello, dicromato de potasio con H2 diluido SO4 acidificar y cubrir con 1 cm de éter (¡deducción!), agregar la muestra y agitar. La fase de éter se vuelve azulada.
- Detección como ion peroxotitanilo(IV) ([Ti(O2 )OH])
La detección con "amarillo de titanio" (que no debe confundirse con un tinte del mismo nombre) es muy sensible. Los iones de titanio (IV) (incoloros), incluso con trazas de peróxido de hidrógeno, dan como resultado el ion peroxotitanilo de color amarillo anaranjado intenso. A la inversa, por lo tanto, también se puede analizar una sustancia para titanio (IV) con peróxido de hidrógeno.
- Detección con permanganato de potasio
Para determinar la concentración en soluciones acuosas, p. B. Baños de blanqueo La determinación se realiza oximétricamente con solución de permanganato de potasio n/10 en solución de ácido sulfúrico (cambio a coloración rosa pálido permanente (duración aprox. 1 min.) según la siguiente ecuación:
Fisiología
El peróxido de hidrógeno es altamente corrosivo, especialmente como vapor. Si te cae peróxido de hidrógeno en la piel, debes enjuagar bien la zona con agua (dilución), o al menos retirarlo de la piel inmediatamente. Mata rápidamente las células de la piel, que luego se vuelven blancas.
En general, el peróxido de hidrógeno tiene un efecto citotóxico y, debido a su fuerte toxicidad para muchos microorganismos procarióticos, tiene un efecto desinfectante.
El peróxido de hidrógeno se forma en numerosos procesos bioquímicos. En el ciclo biológico, se forma a través del metabolismo oxidativo del azúcar. El organismo se protege contra sus efectos tóxicos con la ayuda de enzimas - catalasas, peroxidasas - que lo convierten de nuevo en O2 no tóxico. y H2 Descomponer O.
Después de la fertilización por un espermatozoide, el óvulo femenino produce brevemente bajas concentraciones de peróxido de hidrógeno para matar a otros espermatozoides.
Además, el peróxido de hidrógeno es una molécula de señalización para inducir la defensa de la planta contra los patógenos (aspecto de la citotoxicidad).
Uso
Blejía
El peróxido de hidrógeno es un agente blanqueador, por lo que se utiliza en cosmética para decolorar el cabello y blanquear los dientes. A menudo se usa como un peróxido unido a la carbamida.
- Rubio platino, la máxima evitación de color en el cabello, la humanidad le debe al peróxido de hidrógeno. El líquido extremadamente reactivo destruye los pigmentos de color del cabello.
En todo el mundo, la mayor aplicación se puede ver en el blanqueo de pulpa respetuoso con el medio ambiente. La pulpa se obtiene de la madera y la lignina que contiene con H2 O2 blanqueado. El principal uso de la pulpa es en la fabricación de papel, servilletas, pañuelos, etc.
En la artesanía, el peróxido de hidrógeno se utiliza para blanquear, es decir, para aclarar, la madera, p. B. durante la restauración o renovación.
El peróxido de hidrógeno o los agentes blanqueadores que contienen peróxido de hidrógeno, como una mezcla de ácido peroxiacético y peróxido de hidrógeno, también se utilizan en la publicidad con la palabra artificial oxígeno activo. llamado.
Desinfección y esterilización
Para la desinfección, el peróxido de hidrógeno se usa como una solución al tres por ciento en la boca y la garganta, p. B. en odontología; también se usa para desinfectar lentes de contacto en limpiadores de lentes de contacto y para esterilizar materiales de empaque, así como para desinfectar las manos. También se usa en cremas para la piel del rostro para abrir los poros y combatir las espinillas y las imperfecciones. A menudo se utiliza para limpiar aguas residuales industriales y para desinfectar el agua de las piscinas.
En la industria alimentaria, el peróxido de hidrógeno al 30 % se utiliza en sistemas de llenado aséptico para esterilizar botellas de PET Muchos alimentos (bebidas, leche, productos lácteos, salsas, sopas, etc.) se envasan asépticamente en cajas de cartón, vasos, botellas y láminas para mejorar vida útil y calidad del producto. El proceso más utilizado se basa en la esterilización con peróxido de hidrógeno concentrado (35%). El alto efecto bactericida del H2 O2 , la compatibilidad medioambiental y la buena viabilidad técnica son las razones del uso generalizado de este proceso. En la práctica operativa, se hace una distinción entre el rociado y el proceso de baño de inmersión.
Suministro de oxígeno
El peróxido de hidrógeno se puede utilizar en acuarios para suministrar oxígeno. El oxígeno se genera en un oxidante. Para hacer esto, el peróxido de hidrógeno se divide en agua y radicales de oxígeno en un recipiente en el acuario con la ayuda de un catalizador.
Uso de varios efectos al mismo tiempo
Al renovar interiores, se puede usar peróxido de hidrógeno para combatir el crecimiento de moho. Como desinfectante, puede matar las células biológicamente activas (fungicida) y destruir las esporas (esporicida). Tampoco puede usarse como blanqueador Residuos eliminados del revestimiento - sobre una superficie porosa blanca - "ópticamente inofensivo". El peróxido de hidrógeno es preferible al alcohol o al hipoclorito de sodio porque estas sustancias son subproductos como B. sales que se pueden producir en el subsuelo. El alcohol no es esporicida ni blanqueador en comparación con el peróxido de hidrógeno.
El peróxido de hidrógeno también se utiliza para blanquear y desinfectar en la preparación de huesos. En odontología, H2 O2 se utiliza para la desinfección local del tejido dental y para detener el sangrado durante intervenciones menores.
En agricultura, el peróxido de hidrógeno se utiliza para desinfectar invernaderos y para oxigenar medios de cultivo hidropónico.
Biología
Para determinar cultivos bacterianos se realiza el test de catalasa con una solución de peróxido de hidrógeno al 3%. La mayoría de las bacterias aeróbicas y anaeróbicas facultativas, así como los hongos, tienen la enzima catalasa, que es capaz de descomponer el H2, que es tóxico para las células. O2 dividir.
El peróxido de hidrógeno se puede utilizar en medicina forense para detectar sangre. En 1818, Louis Jacques Thenard descubrió que la peroxidasa de la hemoglobina descompone el peróxido de hidrógeno. Christian Friedrich Schönbein desarrolló un análisis de sangre a partir de esto en 1863. Hoy, sin embargo, la prueba Kastle-Meyer, más sensible, se usa para detectar sangre.
Experimentalmente, el peróxido de hidrógeno se usa en biología para inducir la muerte celular programada en células eucariotas aisladas.
Cáusticos
En microelectrónica, la mezcla de ácido sulfúrico y peróxido de hidrógeno, llamada "piraña", se usa para limpiar la superficie de las obleas y producir una capa delgada de óxido hidrofílico de alrededor de 3 a 4 nm de espesor sobre las obleas. Hoy en día el término "SPM" (Mezcla de Peróxido Sulfúrico) es más común. La aplicación principal es la eliminación de fotorresistentes.
En la fabricación de placas de circuito impreso (PCB), se utilizan baños de grabado de cloruro de cobre para eliminar el cobre:
-
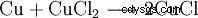 .
. - El cobre elemental reacciona con el cloruro de cobre(II) para formar cloruro de cobre(I). Esta es una proporción.
El peróxido de hidrógeno se utiliza junto con el ácido clorhídrico para regenerar los baños de grabado de cloruro de cobre:
-
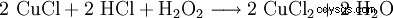 .
. - El cloruro de cobre (II) se regenera haciendo reaccionar el cloruro de cobre (I) con peróxido de hidrógeno y ácido clorhídrico. El átomo de cobre se oxida.
La adición de peróxido de hidrógeno y ácido clorhídrico se controla a través del potencial redox.
Motores cohete/torpedo
Como proveedor de energía y oxígeno (descomposición a través de dióxido de manganeso, por ejemplo), se utilizó en forma concentrada en propulsores de cohetes (por ejemplo:Max Valier, Messerschmitt Me 163) y propulsores submarinos (Walter U-Boot). El peróxido de hidrógeno, descompuesto con la ayuda de permanganato de potasio, también se utilizó como propulsor para las bombas de combustible (500 hp) del A4. El peróxido de hidrógeno sin descomponer se utilizó como portador de oxígeno, líquido a temperatura normal, en cohetes británicos (por ejemplo, Black Arrow) y se quemó allí con queroseno.
El peróxido de hidrógeno tiende a descomponerse sin control. Así falleció el 16 de julio de 1934 el Dr. Kurt Wahmke y dos técnicos en Kummersdorf en la explosión de un motor propulsado por peróxido de hidrógeno. Debido al peligro de uso y manejo (efecto corrosivo, descomposición incontrolada, explosión si el tanque y el sistema de tuberías están contaminados), el uso ahora está limitado a motores de cohetes pequeños (intentos de récord, motores de control).
El hundimiento del submarino nuclear ruso Kursk en 2000 se rumoreaba que era causado por una fuga de peróxido de hidrógeno de un tanque en un torpedo y luego reaccionaba con partes de cobre, provocando la ruptura del torpedo.
Fabricación de explosivos
En presencia de un catalizador adecuado, el peróxido de hidrógeno reacciona con la acetona para formar peróxido de acetona. El peróxido de acetona es un explosivo, pero no se usa comercialmente porque su manipulación es muy insegura. Más precisamente, el peróxido de acetona también se denomina triperóxido de triacetona, abreviado TATP. Otros explosivos hechos con peróxido de hidrógeno incluyen hexametilen triperóxido diamina (HMTD).
Según los expertos del Instituto Fraunhofer de Tecnología Química, el TATP se utiliza en la mayoría de los atentados suicidas en Israel. Se dice que los atentados del 7 de julio de 2005 en el metro de Londres (55 muertos) también fueron perpetrados con TATP. Finalmente, el 4 de septiembre de 2007, tres islamistas formados en Pakistán fueron arrestados en Oberschledorn, Sauerland, que querían producir TATP a partir de 730 kilogramos de una solución de peróxido de hidrógeno al 35% para atacar instalaciones estadounidenses y restaurantes en Alemania frecuentados por ciudadanos estadounidenses.
Por otro lado, los expertos desconocen en detalle cómo los terroristas pudieron detonar TATP elaborados con peróxido de hidrógeno de manera controlada. En particular, en un intento frustrado de introducir de contrabando explosivos líquidos en un avión en Londres en 2007, se cuestionó si se podía producir a bordo peróxido de acetona adecuado utilizando botellas de peróxido de hidrógeno y acetona de contrabando.
Referencias
- Werner R. Thiel:Nuevas rutas para el peróxido de hidrógeno:¿alternativas a los procesos establecidos? Angewandte Chemie 111(21), págs. 3349-3351 (1999)
- Heribert Offermanns, Gunther Dittrich, Norbert Steiner:Peróxido de hidrógeno en la protección y síntesis ambiental . La química en nuestro tiempo 34(3), págs. 150–159 (2000), ISSN 0009-2851
Referencias
- ↑ Entrada sobre peróxido de hidrógeno en la base de datos de sustancias GESTIS de la BGIA, recuperada el 16/11/2007 (se requiere JavaScript)
- ↑ Süddeutsche Zeitung del 6 de septiembre de 2007, p. 2:"Enciclopedia actual:peróxido de hidrógeno “. Firmado:mkf
- ↑ La información de este párrafo se basa en la de mkf artículo firmado "Enciclopedia actual:Peróxido de hidrógeno “ en la página 2 del Süddeutsche Zeitung del 6.9.2007.
- ↑ Süddeutsche Zeitung del 6 de septiembre de 2007, página 1 y sig.
- ↑ netzeitung.de
- ↑ Rundschau-online.de
- ↑ Este párrafo se refiere a oraclesyndicate - Karl Weiss y el artículo de Wikipedia Peróxido de acetona.