| fórmula estructural | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| K | |||||||||
| General | |||||||||
| Nombre | Nitrito de potasio | ||||||||
| Otros nombres | Ácido nitroso potásico, E 249 | ||||||||
| Fórmula molecular | KNO2 | ||||||||
| Número CAS | 7758-09-0 | ||||||||
| Breve descripción | sólido amarillo blanquecino | ||||||||
| Propiedades | |||||||||
| Masa molar | 85,10 g mol | ||||||||
| Estado de la materia | arreglado | ||||||||
| Densidad | 1,92 g·cm | ||||||||
| Punto de fusión | 441 °C | ||||||||
| Punto de ebullición | Descomposición | ||||||||
| Solubilidad | bueno en agua (2810 g/L a 20 °C) | ||||||||
| Instrucciones de seguridad | |||||||||
| |||||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||||
Nitrito de potasio , KNO2 (también:nitrato de potasio , inglés:nitrito de potasio ), es la sal de potasio del ácido nitroso HNO2 .
Propiedades
El nitrito de potasio forma cristales incoloros a ligeramente amarillentos, altamente higroscópicos (=que atraen la humedad) que se disuelven fácilmente en agua cuando se enfría, la solución reacciona alcalina. Los cristales se descomponen a partir de los 360 °C. Por lo demás, se comporta de manera similar al nitrito de sodio, es decir, se oxida (especialmente a temperaturas más altas) y reacciona violentamente con metales como el aluminio (¡especialmente en forma de polvo!), compuestos secos de amonio (como el sulfato de amonio), cianuros y muchos compuestos orgánicos. Es un agente reductor y se convierte lentamente en nitrato de potasio KNO3 en el aire oxidado.
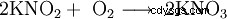
El nitrito de potasio es tóxico; en general, los nitritos pueden reaccionar con ciertas aminas en condiciones adecuadas para formar nitrosaminas cancerígenas. El nitrito se puede detectar con sulfato ferroso y ácido sulfúrico concentrado al volverse marrón.
Ocurrencia y producción
En la naturaleza, los nitritos se producen como etapas intermedias en el ciclo del nitrógeno, tanto en la nitrificación (unión de nitrógeno) como en la desnitrificación (liberación de nitrógeno). Técnicamente, el nitrito de potasio se obtiene mediante la acción de los óxidos de nitrógeno en una solución de hidróxido de potasio.
Uso
El nitrito de potasio se puede utilizar como aditivo alimentario con el número E 249 (Conservantes) se pueden usar bajo ciertas condiciones en la sal de curado de nitrito (cloruro de sodio con nitrito de potasio y nitrito de sodio). Le da a la carne un color rojo permanente a través de la formación de nitrosomyoglobina. Los productos cárnicos y embutidos pueden contener un múltiplo del límite de nitrito del agua potable.
Fuentes
- ↑ Entrada para CAS no. 7758-09-0 en la base de datos de sustancias GESTIS de la BGIA, recuperada el 14 de diciembre de 2007 (se requiere JavaScript)



