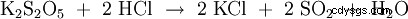| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
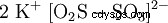 | |||||||
| General | |||||||
| Nombre | Disulfito de Potasio | ||||||
| Otros nombres |
| ||||||
| Fórmula molecular | K2 S2 O5 | ||||||
| Número CAS | 16731-55-8 | ||||||
| Breve descripción | polvo incoloro (blanco) que huele a dióxido de azufre | ||||||
| Propiedades | |||||||
| Masa molar | 222,33 g mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 2,34 g cm | ||||||
| Punto de fusión | 190 °C (descomposición) | ||||||
| Punto de ebullición | No aplicable | ||||||
| Solubilidad | 450 g/l (20 ºC) en agua, insoluble en alcohol | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| LD50 | 2300 mg/kg (oral, rata) | ||||||
| WGK | 1 (ligeramente peligroso para el agua) | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Disulfito de potasio (K2 S2 O5 ) o metabisulfito de potasio , Pirosulfito de potasio llamado, es una sal de potasio de ácido disulfuroso, que no es estable en la forma libre. Los disulfitos tienen un enlace azufre-azufre bastante largo e inestable. El disulfito de potasio se utiliza principalmente como conservante (E 224) en la industria alimentaria. En condiciones ácidas, el compuesto se separa del dióxido de azufre:
Obtención y visualización
Se produce por dimerización térmica (condensación) de hidrogenosulfito de potasio con eliminación de agua (1), o por reacción de dióxido de azufre y sulfito de potasio en solución de hidróxido de potasio (2):
- (1)
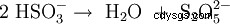
- (2)
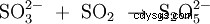
Uso
El aditivo alimentario disulfito de potasio (E 224) se utiliza como conservante, antioxidante y estabilizador del color en los alimentos (p. ej., también en la sulfuración del vino).
También se usa comúnmente como agente reductor en la industria química, para blanquear azúcar, como cáustico en la industria electrónica y como componente de fijadores en la industria fotográfica.
Referencias
- ↑ datos-de-materiales-peligrosos.de [1]
- ↑ inorganics.basf.com [2]
- ↑ Merck - ChemDAT.info [3]
- ↑ metalograf.de [4]