| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Allmänt | |||||||
| Namn | Urea | ||||||
| Andra namn |
| ||||||
| Molekylformel | CH4 N2 O | ||||||
| CAS-nummer | 57-13-6 | ||||||
| Kort beskrivning | färglöst kristallint fast ämne med en ammoniakliknande lukt | ||||||
| Egenskaper | |||||||
| Molarmassa | 60,06 g mol | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 1,3230 g cm | ||||||
| Smältpunkt | 132,5-134,5°C | ||||||
| Kokpunkt | Nedbrytning från 130 °C | ||||||
| Ångtryck | 0,2 Pa (75°C) | ||||||
| Löslighet | lättlöslig i vatten:ca 1000 g l (20 °C), löslig i etanol:50 g l (20 °C), lättlöslig i eter och kloroform | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| WGK | 1 | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Kbamid (Latin urea), även känd som kolsyradiamid – inte att förväxla med urinsyra – är en organisk förening som produceras av många djur som en slutprodukt av omsättningen av kväveföreningar (t.ex. aminosyror) i s.k. ureacykeln och utsöndras i urinen. Ren urea är ett vitt, kristallint, giftfritt och hygieniskt fast ämne med en svag lukt av ammoniak.
Historik
Urea var den första syntetiskt framställda organiska föreningen. Det upptäcktes som ett ämne av Hilaire Rouelle 1773 och syntetiserades först på konstgjord väg av Friedrich Wöhler 1828 genom att reagera kaliumcyanat och ammoniumsulfat. Detta stred mot den då utbredda föreställningen att organiska ämnen i princip bara kan hittas i levande varelser genom den så kallade "vis vitalis" (livskraft) skulle kunna skapas och bana väg för organisk kemi.
Fysiologisk betydelse
Urea kommer från protein- och aminosyrametabolismen och tillhör urinsubstanserna. För att förhindra bildning av ammoniak (NH3 ) från aminogrupperna överförs dessa till den icke-toxiska ureamolekylen i levern under ureacykelns lopp, som utsöndras som en metabolisk slutprodukt via njurarna.
Sjukdomar som akut eller kronisk njursvikt och diabetisk nedsatt njurfunktion kan leda till ökade ureavärden i serum/plasma.
Störningar och egenheter: Ett högt proteinintag leder till ökade ureavärden även vid normal njurfunktion, vilket gör det till en dålig njurparameter.
Applikationer
På grund av sin höga kvävehalt på 46 % är urea det viktigaste kvävegödselmedlet i världen. På grund av dess höga vattenbindningsförmåga används urea också ofta som en fuktgivande faktor i kosmetika. På apoteket är urea känt som ett keratolytikum. Denna egenskap används i olika recept. Till exempel är det högkoncentrerat (40%) i pastor tillsammans med ett svampdödande medel (svampmedel) mot nagelsvamp (onykomykos), varvid urean mjukar upp nageln så att det infekterade nagelämnet kan avlägsnas bit för bit. Det används också som en fuktighetskräm i salvor för att bekämpa atopiska eksem och lavsjukdomar.
Cigaretttillverkare tillsätter urea till tobak så att nikotinet bättre kan absorberas genom att höja pH-värdet. På så sätt blir påstådda lätta cigaretter med lågt nikotinvärde på förpackningen starka cigaretter.
Urea kan också användas som ersättning för vägsalt; av kostnadsskäl är detta dock inte lönsamt.
Inom dieselmotortekniken sprutas urea in bakom ett sotfilter i det heta avgasflödet för att minska kväveoxiderna i avgaserna. Förbrukningen är cirka 2 till 8 % i förhållande till bränslet.
Det läggs till livsmedel som stabilisator. I EU är det listat som en livsmedelstillsats med beteckningen E 927b Godkänd exklusivt för tuggummi utan tillsatt socker.
Egenskaper
När det smälter sönderfaller urea med frigöring av ammoniak (NH3 ) till Biuret:
Industriell tillverkning
Karbamid tillverkas industriellt i stora mängder (2004:127 miljoner ton världen över) och används t.ex. B. som kvävegödsel eller som NOx -Reduktionsmedel i SNCR-processen. I länder med stora naturgasreserver, som tidigare helt enkelt bränts av, omvandlas naturgas nu till urea. För detta ändamål används stora anläggningar som slutligen producerar urea från naturgas, luft och vatten i processtegen väteproduktion → ammoniakproduktion → ureasyntes. CO2 binds som urea och släpps inte ut i atmosfären. Urean, som initialt är i lösning, omvandlas till granulat och säljs i säckar eller lösa. De största anläggningarna i världen producerar cirka 4 000 ton urea per dag.
Reaktionsekvationer:
-
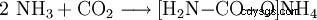
- Ammoniak och koldioxid reagerar och bildar ammoniumkarbamat.
-
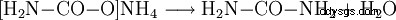
- Ammoniumkarbamat reagerar och bildar urea och vatten.
En industriell vidare användning av urea är framställning av melamin, som används t.ex. B. bearbetas med formaldehyd för att bilda syntetiska hartser, och urea-formaldehydhartser (urea harts, så kallade UF-hartser), z. B. används för tillverkning av spånskivor.
Källor
- ↑ BGIA GESTIS ämnesdatabas:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 23 juli 2007
- AdBlue
- Kbamidnitrat
- tiourea
