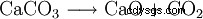| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Ingen strukturformel tillgänglig | |||||||
| Allmänt | |||||||
| Namn | Kalciumoxid | ||||||
| Andra namn |
| ||||||
| Molekylformel | CaO | ||||||
| CAS-nummer | 1305-78-8 | ||||||
| Kort beskrivning | vitt pulver | ||||||
| Egenskaper | |||||||
| Molarmassa | 56,08 g mol | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 3,37 g cm (20 °C)> | ||||||
| Smältpunkt | 2570-2580 °C | ||||||
| Kokpunkt | 2850 °C (100 mbar) | ||||||
| Ångtryck | inte tillämpligt | ||||||
| Löslighet | knappast i vatten, 1,65 g l (vid 20 °C), häftig reaktion | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| MAK | lyfts upp | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Kalciumoxid (även bränd kalk , quicklime , quicklime eller lime ) är ett vitt pulver som reagerar med vatten med värmeutveckling. Reaktionen ger kalciumhydroxid (släckt kalk ) bildas:
Quicklime är softburned och Härdad framstående.
Tillverkning
- Huvudartikel: Teknisk kalkcykel
I industriell skala produceras kalciumoxid genom kalkförbränning. Från en temperatur på runt 800 °C avsyras kalksten (kalciumkarbonat), dvs koldioxid stöts ut och kalciumoxid bildas.
Man skiljer på bränd kalk bland annat efter den hastighet med vilken kalken reagerar med vatten (den så kallade släckningsprocessen):
<2 min reaktionstid:mjuk lime
2 - 6 min reaktionstid:bränd kalk
> 6 min reaktionstid:bränd kalk
Det finns dock inga exakta definitioner.
Skillnaderna i reaktionshastigheten är en konsekvens av CaO:s kristallitstorlek, porvolym och specifik yta, vilka påverkas av bränningstemperaturen och varaktigheten.
Mjuk bränd kalk produceras vid temperaturer på 900-1000 °C, hårt bränd kalk vid upp till 1400 °C, varvid varaktigheten av temperatureffekten vanligtvis också spelar roll.
När mindre mängder (laboratorieskala) är tillräckliga kan det erhållas genom att oxidera kalcium.
Reaktiv kalciumoxid erhålls genom att termiskt sönderdela kalciumhydroxid, som sönderdelas vid 550 °C under atmosfärstryck till kalciumoxid och vatten. Kalciumoxiden som bildas under dessa förhållanden är inte särskilt kristallin, så den är mycket reaktiv.
Bränd kalk (snabbäkta) och släckt kalk (kalciumhydroxid) är mycket frätande (pH 12-13), kontakt med ögonen kan orsaka blindhet!
Användning
Bläckkalk används i byggbranschen som tillsats till murbruk och det är också en mindre komponent i cementklinker. Inom kemin används ämnet även som torkmedel. Andra användningsområden för bränd kalk är t.ex. B. gödselkalk, framställning av kalciumkarbid och för framställning av kalkbruk, kalkputs och kalkfärg samt för användning som neutraliseringsmedel.
Ett av de huvudsakliga användningsområdena är avsvavling av tackjärn, där svavlet [S] förekommer som en följeslagare [FeS] och måste lösas ut på vägen till stålet (omvandlaren). Kalk (CaO) blåses antingen ut. i tackjärnet eller med en omrörare inblandad. Kalken kombineras med svavlet och bildar kalciumsulfid [CaS] och stiger upp till ytan där den lägger sig som slagg. Detta avlägsnas med en skrapmaskin efter avsvavling.
Kalciumoxid är en viktig applikation som prekursor vid produktion av kalciumhydroxid genom tillsats av vatten (släckt kalk eller släckt lime ).
Den släckta kalken används bland annat som ett alternativ till kalksten vid rökgasavsvavling. Mängden som används här är ca 1,8 gånger mindre än för kalksten. Gipsen (kalciumsulfat) som erhålls från bränd kalk har en vithetsgrad på 80 % och kan användas kommersiellt. På grund av dess höga reaktivitet krävs lägre förbrukningsmängder. Nackdelen är dess betydligt högre pris jämfört med kalksten.
Klorkalk kan framställas av kalciumhydroxid genom ytterligare reaktioner.
Det läggs till livsmedel som en surhetsreglerande medel. Det används i första hand som ett så kallat tekniskt tillsatsmedel som inte längre finns i det färdiga livsmedlet.I EU är det klassat som en livsmedelstillsats med beteckningen E 529 utan maxgräns (quantum satis ) allmänt godkänd för livsmedel.
Källor
- ↑ Post om kalciumoxid i GESTIS substansdatabas för BGIA, hämtad den 4 oktober 2007 (JavaScript krävs)
- ↑ Materialsäkerhetsdatablad (Merck)