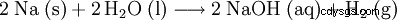| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Allmänt | |||||||
| Namn | Natriumhydroxid | ||||||
| Andra namn | Kaustiksoda, kaustiksoda, kaustiksoda, täljsten, natriumhydroxid, natriumhydroxid, kaustiksoda (vattenlösning), E 524 | ||||||
| Molekylformel | NaOH | ||||||
| CAS-nummer | 1310-73-2 | ||||||
| Kort beskrivning | vitt kristallint fast ämne, ofta i form av pellets | ||||||
| Egenskaper | |||||||
| Molarmassa | 39,997 g mol | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 2 130 g cm | ||||||
| Smältpunkt | 322°C | ||||||
| Kokpunkt | 1388°C | ||||||
| Ångtryck | 13 Pa (618 °C) | ||||||
| Löslighet |
Lättlösligt i vatten: | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| MAK | ej specificerat | ||||||
| WGK | 1 – något farligt för vatten | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Natriumhydroxid (även kaustiksoda , kaustiksoda ), kemisk formel NaOH , är ett vitt hygroskopiskt fast ämne. Det löser sig i vatten under generering av stora mängder värme och ger starkt alkalisk kaustiksoda (pH ca. 14 vid c =1 mol/l). Det reagerar med koldioxiden i luften och bildar natriumkarbonat och förvaras därför i lufttäta behållare. För att förhindra att natriumhydroxiden binder vatten från luften kan den förvaras tillsammans med ett torkmedel. Som en stark bas tränger den undan svagare och mer flyktiga baser från deras salter.
Världsproduktionen 2001 var 46 miljoner ton.
Tillverkning
- Reaktion av natriumkarbonat med kalciumhydroxid för att bilda natriumhydroxid och kalciumkarbonat:
Det lätt lösliga kalciumkarbonatet filtreras bort. Den lättlösliga natriumhydroxiden förblir i filtratet.
- Elektrolys av natriumklorid till kaustiksoda, väte och klorgas (kloralkalielektrolys).
Det finns flera industriella processer:
- Amalgamprocedur
- Diafragmaprocedur
- membranprocess
(se även klor-alkalielektrolys)
Gemensamt för alla processer är ytterligare renings- och koncentreringssteg för att komma fram till vattenfri natriumhydroxid.
- Natriumhydroxid kan erhållas i laboratoriet genom att reagera elementärt natrium med vatten för att bilda kaustiksoda och väte:
- Efter att kaustiksodan har avdunstat, finns fast natriumhydroxid kvar:
Användning
- Tillverkning av olika tvålar (kaustiksoda)
- Tillverkning av färgämnen (kaustiksoda)
- Tillverkning av cellulosa från trä och halm
- Merceriserande bomull
- Rengöring av fett, olja och petroleum
- Bauxitrötning (prekursor i aluminiumproduktion)
- Syntes av olika kemikalier (t.ex. natriumhypoklorit, natriumfosfat, natriumsulfid, natriumaluminat)
- Syntes av myrsyra
- Produktion av avmineraliserat vatten:regenerering av jonbytare
- Utveckling av exponerat kretskortsmaterial inom elektronik (ca 10g/l vid 20°C)
- En del av avloppsrengörare
- Gör kringlor för den bruna färgen och den "tvålaktiga" smaken
- Regenerering av avjonisatorer för laboratorie- och akvariebehov
- Etsning av mässings-, nickelsilver- och kopparplåtar för modelltillverkaren
- Bestämning av surheten i vin med blålut
- Rengöring av tankar av rostfritt stål
- Ta bort gammal färg (borttagning)
- För att räta ut frissigt hår (avslappnande)
- Natron Locomotive
- Detektion av alla organiska kväveföreningar ("Manutdetektering")
- Borttagning av skal från frukt och grönsaker (!) under industriell bearbetning
- härdningsmedel löst i vatten för härdning av stål
Experimentellt exempel
Om du tillsätter lite natriumhydroxid i vattnet och sedan rör om det kommer lösningen att värmas upp. Detta är lämpligt som ett enkelt exempel på en exoterm lösningsprocess som används i till exempel skolan. Den motsatta effekten, en endoterm upplösningsprocess, kan observeras vid upplösning av kaliumnitrat eller ammoniumnitrat i vatten, med effekten mycket starkare vid upplösning av ammoniumnitrat (temperatursänkning med cirka 10 K).
Källor
- ↑ BGIA GESTIS ämnesdatabas:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 15 februari 2007
- Natrium