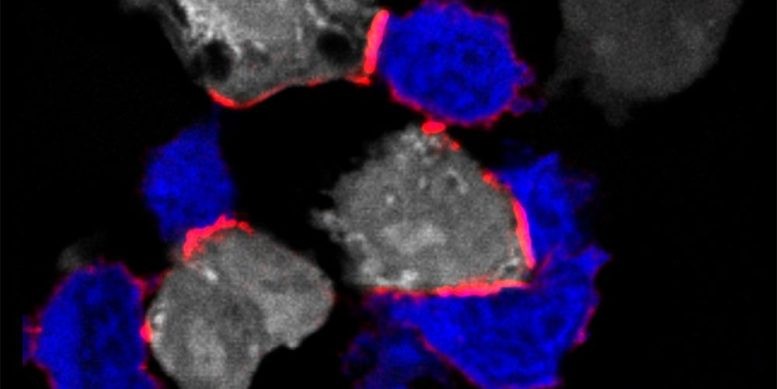
Obraz immunofluorescencyjny przedstawiający limfocyty T (kolor niebieski) atakujący komórki nowotworowe (kolor biały) poprzez tworzenie synapsy immunologicznej z LFA-1 (konformacja otwartej główki – oznaczona kolorem czerwonym). W nowym badaniu zidentyfikowano magnez pozakomórkowy jako krytyczny modulator immunologiczny limfocytów T CD8+. Źródło:J. Loetscher i in., Cell (2022)
Poziom magnezu we krwi jest ważnym czynnikiem w zdolności układu odpornościowego do zwalczania patogenów i komórek rakowych. Pisanie w dzienniku Cell, naukowcy z Uniwersytetu w Bazylei i Szpitala Uniwersyteckiego w Bazylei poinformowali, że limfocyty T potrzebują wystarczającej ilości magnezu, aby działać wydajnie. Ich odkrycia mogą mieć ważne implikacje dla pacjentów z rakiem.
Niedobór magnezu wiąże się z różnymi chorobami, takimi jak infekcje i nowotwory. Wcześniejsze badania wykazały, że narośle nowotworowe rozprzestrzeniają się szybciej w ciałach myszy, gdy zwierzęta otrzymywały dietę ubogą w magnez – i że ich obrona przed wirusami grypy była również osłabiona. Jednak do tej pory przeprowadzono niewiele badań dotyczących tego, jak dokładnie ten minerał wpływa na układ odpornościowy.
Teraz naukowcy pod kierunkiem profesora Christopha Hessa z Wydziału Biomedycyny Uniwersytetu w Bazylei i Szpitala Uniwersyteckiego w Bazylei oraz Wydziału Medycyny Uniwersytetu w Cambridge odkryli, że limfocyty T mogą skutecznie eliminować nieprawidłowe lub zainfekowane komórki tylko w magnezie. bogate środowisko. W szczególności magnez jest ważny dla funkcji białka powierzchniowego komórek T zwanego LFA-1.
LFA-1 działa jako miejsce dokowania, które odgrywa kluczową rolę w aktywacji limfocytów T. „Jednak w stanie nieaktywnym to miejsce dokowania ma wygiętą konformację i dlatego nie może skutecznie wiązać się z zainfekowanymi lub nieprawidłowymi komórkami” – wyjaśnia Christoph Hess. „W tym miejscu do gry wkracza magnez. Jeśli magnez jest obecny w wystarczających ilościach w pobliżu limfocytów T, wiąże się z LFA-1 i zapewnia, że pozostanie w wydłużonej – a zatem aktywnej – pozycji.”
Potencjalnie ważne odkrycia dla pacjentów z rakiem
Fakt, że magnez jest niezbędny do funkcjonowania limfocytów T, może być bardzo ważnym odkryciem dla nowoczesnych immunoterapii nowotworów. Terapie te mają na celu mobilizację układu odpornościowego – w szczególności cytotoksycznych komórek T – do walki z komórkami nowotworowymi. W modelach eksperymentalnych naukowcy byli w stanie wykazać, że odpowiedź immunologiczna komórek T przeciwko komórkom nowotworowym została wzmocniona przez wzrost lokalnego stężenia magnezu w guzach.
„Aby zweryfikować tę obserwację klinicznie, szukamy teraz sposobów na zwiększenie stężenia magnezu w guzach w sposób ukierunkowany” – mówi Christoph Hess. Obiecujący charakter tych strategii potwierdzają dalsze analizy przeprowadzone przez zespół badawczy współpracujący z Christophem Hessem i jego stażem, dr Jonasem Lötscherem, głównym autorem badania. Korzystając z danych z wcześniej zakończonych badań pacjentów z rakiem, naukowcy byli w stanie wykazać, że immunoterapie były mniej skuteczne u pacjentów z niewystarczającym poziomem magnezu we krwi.
To, czy regularne przyjmowanie magnezu wpływa na ryzyko zachorowania na raka, jest pytaniem, na które nie można odpowiedzieć na podstawie istniejących danych, mówi Lötscher. „W następnym kroku planujemy prospektywne badania w celu przetestowania klinicznego wpływu magnezu jako katalizatora dla układu odpornościowego”.
Odniesienie:„Wykrywanie magnezu przez LFA-1 reguluje funkcję efektora komórek T CD8+” autorstwa Jonasa Lötschera, Adrià-Arnau Martí i Líndez, Nicole Kirchhammer, Elisabetta Cribioli, Greta Giordano, Marcel P. Trefny, Markus Lenz, Sacha I. Rothschild, Paolo Strati, Marco Künzli, Claudia Lotter, Susanne H. Schenk, Philippe Dehio, Jordan Löliger, Ludivine Litzler, David Schreiner, Victoria Koch, Nicolas Page, Dahye Lee, Jasmin Grählert, Dmitry Kuzmin, Anne-Valérie Burgener, Doron Merkler, Miklos Pless , Maria L. Balmer, Walter Reith i Jörg Huwyler, 19 stycznia 2022, Cell .
DOI:10.1016/j.cell.2021.12.039
