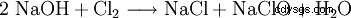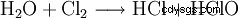| formula strutturale | ||||||||
|---|---|---|---|---|---|---|---|---|
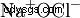 | ||||||||
| Generale | ||||||||
| Nome | Ipoclorito di sodio | |||||||
| Altri nomi | ipoclorito di sodio, ipoclorito di sodio, ipoclorito di sodio, L'eau de Labarraque/Eau de Javel (soluzione acquosa) | |||||||
| Formula molecolare | NaOCl | |||||||
| Numero CAS | 7681-52-9 | |||||||
| Breve descrizione | solido giallo con odore sgradevole e dolce | |||||||
| Proprietà | ||||||||
| Massa molare | 74,44 g mol | |||||||
| Stato della materia | risolto | |||||||
| Densità | 1,2 g cm (soluzione di cloro libero al 13%) | |||||||
| Punto di fusione | 24,5 °C (pentaidrato) | |||||||
| Pressione di vapore | 23 hPa (20 °C) | |||||||
| Solubilità | buono in acqua (293 g/L a 0 °C, 942 g/L a 23 °C, ciascuno pentaidrato) | |||||||
| Istruzioni di sicurezza | ||||||||
| ||||||||
| WGK | 2 – pericoloso per l'acqua | |||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | ||||||||
Ipoclorito di sodio (NaOCl) è il sale sodico dell'acido ipocloroso (noto anche come ipocloroso) (HClO), è una polvere bianca che normalmente contiene sei moli di acqua di cristallizzazione per mole di ipoclorito di sodio. Il nome comune della soluzione acquosa di ipoclorito di sodio è Eau de Labarraque o Eau de Javel , dove l'etichetta Eau de Javel è rigorosamente scorretto. Si tratta di una soluzione di ipoclorito di potassio, eventualmente in miscela con altri sali come il cloruro di potassio; tuttavia, spesso non si distingue.
Ottenere/Rappresentare
L'ipoclorito di sodio viene prodotto introducendo gas di cloro nella soda caustica o mediante elettrolisi di una soluzione di cloruro di sodio.
Questa reazione causa notevoli problemi tecnici. Poiché è formalmente un'idrolisi del cloro secondo
con la successiva neutralizzazione dell'acido cloridrico o dell'acido ipocloroso risultante, è facile vedere che le entalpie di reazione di queste reazioni portano a un forte riscaldamento, a cui tutti gli ipocloriti sono sensibili. Infatti, lo stesso processo chimico viene utilizzato per produrre il clorato, ma facendolo reagire in soluzione calda. Per questo motivo, tutti gli ipocloriti tecnici contengono quantità variabili, a volte elevate, di clorato. La reazione dell'ipoclorito prodotto durante la produzione con il cloro porta infine al clorato.
Utilizzo
Lo scopo dell'uso è lo sbiancamento o la disinfezione (ad es. nelle piscine). L'uso in piscina non è privo di problemi, poiché le quantità da dosare devono essere sufficienti a clorare l'ammoniaca presente (o le ammine) oltre il livello di monoclorammina, poiché solo così è garantita un'adeguata disinfezione.
L'ipoclorito di sodio è anche il principale ingrediente attivo nella disinfezione e nello sbiancamento dei detergenti per la casa come DanKlorix e molti altri. Anche vari antimuffa contengono questo principio attivo.
L'ipoclorito di sodio è utilizzato anche in odontoiatria. Ad esempio, viene utilizzato nel trattamento canalare dei denti infetti da batteri per disinfettarli.
Istruzioni di sicurezza
È necessaria estrema cautela quando si maneggia l'ipoclorito di sodio! Esiste il rischio di esplosione quando l'ipoclorito di sodio reagisce con numerose sostanze e gruppi di sostanze, inclusi agenti riducenti, ammine, acido formico, metanolo, sostanze organiche e pochi altri. Attacca fortemente le mucose quando inalato.
Inoltre, l'ipoclorito di sodio reagisce con acidi (es. acido cloridrico, acido nitrico) e agenti ossidanti (es. perossido di idrogeno, permanganato) talvolta in modo molto violento, generando calore e liberando gas cloro e/o nitrosi.
Il calore o la luce solare da soli possono causare la decomposizione dell'ipoclorito di sodio, rilasciando cloro, acido cloridrico, biossido di cloro e ossigeno, tra le altre cose. Questo deve essere preso in considerazione anche durante lo stoccaggio della sostanza.
Fonti
- ↑ Database delle sostanze BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 12 maggio. 2007