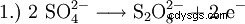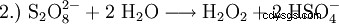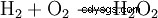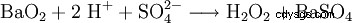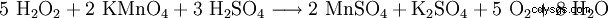| formula strutturale | ||||||||
|---|---|---|---|---|---|---|---|---|
| Generale | ||||||||
| Nome | Perossido di idrogeno | |||||||
| Altri nomi | μ-1κO,2κO'-diossidodiidrogeno, peridrolo, perossido di idrogeno (obsoleto) | |||||||
| Formula molecolare | H2 O2 | |||||||
| Numero CAS | 7722-84-1 (soluzione acquosa) | |||||||
| Breve descrizione | liquido incolore | |||||||
| Proprietà | ||||||||
| Massa molare | 34,02 g mol | |||||||
| Stato della materia | liquido | |||||||
| Densità | 1,45 g cm (20 °C, puro) 1,11 g cm (20 °C, 30%) | |||||||
| Punto di fusione | −0,41 °C (puro) −33 °C (35%) −11 °C (90%) | |||||||
| Punto di ebollizione | 150,2 °C (puro) 108 °C (35%) 142 °C (90%, con decomposizione) | |||||||
| Pressione di vapore | 1,9 hPa (20°C) | |||||||
| Solubilità | completamente miscibile con acqua | |||||||
| Istruzioni di sicurezza | ||||||||
| ||||||||
| MAC | 0,5 ml m o 0,71 mg m | |||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | ||||||||
Perossido di idrogeno (H2 O2 ) è un composto liquido blu pallido, in gran parte stabile di idrogeno e ossigeno, incolore in forma diluita. È leggermente più viscoso dell'acqua, è un acido debole e un agente ossidante molto forte per la maggior parte delle sostanze, che come tale reagisce violentemente con sostanze come ad es. B. reagisce rame, ottone, ioduro di potassio e quindi agisce come un forte candeggina e disinfettante. In una forma altamente concentrata, può essere utilizzato sia come propellente per razzi singolo che come componente.
Proprietà fisiche
L'H2 O2 -La molecola è piegata (angolo diedro =111°). Il perossido di idrogeno puro è molto viscoso a causa della forte reticolazione attraverso i legami idrogeno. Poiché altamente concentrato (=quasi anidro) H2 O2 instabile e si decompone spontaneamente in un'esplosione, soprattutto a contatto con metalli, viene normalmente venduto da banco come soluzione al massimo al 35% in acqua. Per le esigenze industriali, invece, ci sono anche concentrazioni del 50% di H2 O2 in acqua.
Il contatto con una soluzione di perossido di idrogeno superiore al 20% può causare ustioni chimiche. È quindi necessario indossare guanti protettivi durante la manipolazione.
Produzione
In passato, il perossido di idrogeno veniva prodotto principalmente dall'elettrolisi dell'acido solforico. Questo forma acido perossodisolforico, che viene poi idrolizzato di nuovo in acido solforico e perossido di idrogeno.
Oggi, il perossido di idrogeno viene prodotto tecnicamente utilizzando il processo dell'antrachinone. A tale scopo, l'antraidrochinone viene fatto reagire con l'ossigeno atmosferico sotto pressione per formare perossido di idrogeno e antrachinone. Nella fase successiva, l'antrachinone può essere nuovamente ridotto con idrogeno ad antraidrochinone, ecc. L'equazione grossolana è:
Su scala di laboratorio, il perossido di idrogeno viene prodotto anche nel trattamento dei perossidi con acidi. Un reagente storicamente importante è il perossido di bario, che reagisce in una soluzione di acido solforico per formare perossido di idrogeno e solfato di bario.
Le entalpie molari di formazione sono:
- Δf Hgas :−136,11 kJ/mol
- Δf Hliq :−188 kJ/mol
- Δf Hsol :−200 kJ/mol
Proprietà chimiche
Il perossido di idrogeno tende a scomporsi in acqua e ossigeno. Questo rilascia energia di 98,02 kJ/mol:
-
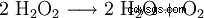
- Sproporzione di due molecole di perossido di idrogeno in acqua e ossigeno.
Questa reazione di decomposizione è catalizzata, tra l'altro, da Mn (vedi dimostrazione) o da altri ioni di metalli pesanti, I e OH. Pertanto H2 O2 - Le soluzioni disponibili in commercio vengono miscelate con stabilizzanti (compreso l'acido fosforico). È un forte agente ossidante. Quando lo stato di ossidazione viene ridotto da −I a −II, come prodotti di reazione si formano solo acqua e ossigeno. Non ci sono sottoprodotti difficili da separare o dirompenti, il che ne semplifica l'uso in laboratorio.
Può anche agire come agente riducente contro agenti ossidanti più forti (es. permanganato di potassio).
Il perossido di idrogeno è un acido molto debole; i suoi sali inorganici ed esteri organici sono gli idroperossidi e i perossidi.
Prova
Per il rilevamento qualitativo, ioni Mn (ad es. MnSO4 ) ammesso. Se si sviluppa gas, il chip test fumante viene utilizzato per verificare la presenza di ossigeno. Se questo risulta essere positivo, in quanto il chip luminoso si illumina, lo era H2 O2 presente.
- Rilevamento come perossido di cromo (CrO(O2 )2 )
Fai le prove del festival. Triossido di cromo CrO3 con perossido di idrogeno nell'intervallo fortemente acido (pH <0) si ottiene il perossido di cromo di colore blu intenso, che si dissolve in etere. Per fare questo, dicromato di potassio con H2 diluito SO4 acidificare e coprire con 1 cm di etere (detrazione!), aggiungere il campione e agitare. La fase eterea diventa bluastra.
- Rilevamento come ione perossotitanil(IV) ([Ti(O2 )OH])
La rilevazione con "giallo titanio" (da non confondere con un colorante omonimo) è molto sensibile. Gli ioni (incolori) di titanio (IV), anche con tracce di perossido di idrogeno, danno luogo allo ione perossotitanile di colore giallo-arancio intenso. Al contrario, una sostanza può quindi essere testata anche per il titanio(IV) con perossido di idrogeno.
- Rilevamento con permanganato di potassio
Per determinare la concentrazione in soluzioni acquose, ad es. B. bagni di candeggio La determinazione viene effettuata ossimetricamente con soluzione di permanganato di potassio n/10 in soluzione di acido solforico (viraggio a colorazione rosa pallido permanente (durata ca. 1 min.) secondo la seguente equazione:
Fisiologia
Il perossido di idrogeno è altamente corrosivo, soprattutto come vapore. Se si ottiene perossido di idrogeno sulla pelle, è necessario sciacquare bene l'area con acqua (diluizione) o almeno rimuoverla immediatamente dalla pelle. Uccide rapidamente le cellule della pelle, che poi diventano bianche.
In generale, il perossido di idrogeno ha un effetto citotossico e, per la sua forte tossicità per molti microrganismi procarioti, ha un effetto disinfettante.
Il perossido di idrogeno si forma in numerosi processi biochimici. Nel ciclo biologico si forma attraverso il metabolismo ossidativo dello zucchero. L'organismo si protegge dai suoi effetti tossici con l'aiuto di enzimi - catalasi, perossidasi - che lo riconvertono in O2 non tossico e H2 Decomponi O.
Dopo la fecondazione da parte di uno spermatozoo, l'ovulo femminile produce brevemente basse concentrazioni di perossido di idrogeno per uccidere altri spermatozoi.
Inoltre, il perossido di idrogeno è una molecola di segnalazione per indurre la difesa della pianta contro gli agenti patogeni (aspetto della citotossicità).
Utilizzo
Candeggina
Il perossido di idrogeno è un agente sbiancante, quindi viene utilizzato nei cosmetici per decolorare i capelli e sbiancare i denti. Viene spesso utilizzato come perossido legato alla carbammide.
- Biondo platino, il massimo per evitare il colore dei capelli, l'umanità deve al perossido di idrogeno. Il liquido estremamente reattivo distrugge i pigmenti di colore nei capelli.
In tutto il mondo, la più grande applicazione può essere vista nello sbiancamento ecologico della polpa. La polpa si ottiene dal legno e dalla lignina che contiene con H2 O2 sbiancato. L'uso principale della polpa è nella produzione di carta, tovaglioli, fazzoletti, ecc.
Nell'artigianato, il perossido di idrogeno viene utilizzato per sbiancare - cioè per schiarire - il legno, ad es. B. durante il restauro o la ristrutturazione.
Il perossido di idrogeno o agenti sbiancanti contenenti perossido di idrogeno, come una miscela di acido perossiacetico e perossido di idrogeno, vengono utilizzati anche nella pubblicità con la parola artificiale ossigeno attivo chiamato.
Disinfezione e sterilizzazione
Per la disinfezione, il perossido di idrogeno viene utilizzato come soluzione al tre percento in bocca e gola, ad es. B. in odontoiatria; viene anche utilizzato per disinfettare le lenti a contatto nei detergenti per lenti a contatto e per sterilizzare i materiali di imballaggio, nonché per disinfettare le mani. Viene anche utilizzato nelle creme per la pelle del viso per aprire i pori e combattere brufoli e imperfezioni. Viene spesso utilizzato per pulire le acque reflue industriali e per disinfettare l'acqua delle piscine.
Nell'industria alimentare, il perossido di idrogeno al 30% viene utilizzato nei sistemi di riempimento asettico per sterilizzare le bottiglie in PET. Molti alimenti (bevande, latte, latticini, salse, zuppe, ecc.) sono confezionati in modo asettico in cartoni, tazze, bottiglie e fogli per migliorare durata e qualità del prodotto. Il processo più comunemente utilizzato si basa sulla sterilizzazione con acqua ossigenata concentrata (35%). L'alto effetto battericida di H2 O2 , la compatibilità ambientale e la buona fattibilità tecnica sono le ragioni dell'uso diffuso di questo processo. Nella pratica operativa, viene fatta una distinzione tra il processo spray e il bagno ad immersione.
Erogazione di ossigeno
Il perossido di idrogeno può essere utilizzato negli acquari per fornire ossigeno. L'ossigeno è generato in un ossidante. Per fare ciò, il perossido di idrogeno viene suddiviso in acqua e radicali dell'ossigeno in un recipiente nell'acquario con l'aiuto di un catalizzatore.
Utilizzo di più effetti contemporaneamente
Quando si rinnovano gli interni, il perossido di idrogeno può essere utilizzato per combattere la formazione di muffe. Come disinfettante, può sia uccidere le cellule biologicamente attive (fungicida) sia distruggere le spore (sporicida). Inoltre non può essere usato come candeggina Residui rimossi del rivestimento - su superficie bianca porosa - "otticamente innocuo". Il perossido di idrogeno è preferibile all'alcool o all'ipoclorito di sodio perché queste sostanze sono sottoprodotti come B. possono produrre sali nel sottosuolo. L'alcol non è né sporicida né sbiancante rispetto al perossido di idrogeno.
Il perossido di idrogeno viene utilizzato anche per lo sbiancamento e la disinfezione nella preparazione delle ossa. In odontoiatria, H2 O2 utilizzato per la disinfezione locale del tessuto dentale e per fermare l'emorragia durante interventi minori.
In agricoltura, il perossido di idrogeno viene utilizzato per disinfettare le serre e per ossigenare i mezzi di coltura idroponici.
Biologia
Per determinare le colture batteriche, il test della catalasi viene effettuato con una soluzione di perossido di idrogeno al 3%. La maggior parte dei batteri aerobi e anaerobici facoltativi, così come i funghi, hanno l'enzima catalasi, che è in grado di scomporre H2, che è tossico per le cellule O2 dividere.
Il perossido di idrogeno può essere utilizzato in medicina legale per rilevare il sangue. Nel 1818 Louis Jacques Thénard scoprì che la perossidasi nell'emoglobina decompone il perossido di idrogeno. Christian Friedrich Schönbein ha sviluppato un esame del sangue da questo nel 1863. Oggi, invece, per rilevare il sangue viene utilizzato il più sensibile test di Kastle-Meyer.
Sperimentalmente, il perossido di idrogeno viene utilizzato in biologia per indurre la morte cellulare programmata in cellule eucariotiche isolate.
Caustiche
Nella microelettronica, la miscela di acido solforico e perossido di idrogeno – chiamata “piranha” – viene utilizzata per pulire la superficie dei wafer e per produrre uno strato di ossido idrofilo sottile, spesso circa 3-4 nm, sui wafer. Al giorno d'oggi il termine "SPM" (miscela di perossido di zolfo) è più comune. L'applicazione principale è la rimozione dei fotoresist.
Nella produzione di circuiti stampati (PCB), i bagni di incisione del cloruro di rame vengono utilizzati per rimuovere il rame:
-
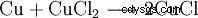 .
. - Il rame elementare reagisce con il cloruro di rame(II) per formare cloruro di rame(I). Questo è un compromesso.
Il perossido di idrogeno viene utilizzato insieme all'acido cloridrico per rigenerare i bagni di incisione del cloruro di rame:
-
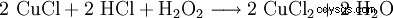 .
. - Il cloruro di rame(II) viene rigenerato facendo reagire il cloruro di rame(I) con perossido di idrogeno e acido cloridrico. L'atomo di rame è ossidato.
L'aggiunta di perossido di idrogeno e acido cloridrico è controllata tramite il potenziale redox.
Motori a razzo/siluro
Come fornitore di energia e ossigeno (decomposizione tramite biossido di manganese, ad esempio), è stato utilizzato in forma concentrata negli azionamenti di razzi (ad es.:Max Valier, Messerschmitt Me 163) e sottomarini (Walter U-Boot). Il perossido di idrogeno, decomposto con l'aiuto del permanganato di potassio, è stato utilizzato anche come propellente per le pompe del carburante (500 CV) dell'A4. Il perossido di idrogeno non decomposto è stato utilizzato come vettore di ossigeno, liquido a temperatura normale, nei razzi britannici (es. Black Arrow) e lì bruciato con cherosene.
Il perossido di idrogeno tende a decomporsi in modo incontrollato. Così morì il 16 luglio 1934 il dott. Kurt Wahmke e due tecnici a Kummersdorf all'esplosione di un motore alimentato a perossido di idrogeno. A causa del pericolo nell'uso e nella manipolazione (effetto corrosivo, decomposizione incontrollata, esplosione se il serbatoio e il sistema di tubazioni sono contaminati), l'uso è ora limitato ai piccoli motori a razzo (tentativi di record, motori di controllo).
L'affondamento del sottomarino nucleare russo Kursk nel 2000 si diceva che fosse causato dal perossido di idrogeno che fuoriusciva da un carro armato in un siluro e poi reagiva con parti in rame, provocando la rottura del siluro.
Produzione di esplosivi
In presenza di un opportuno catalizzatore, il perossido di idrogeno reagisce con l'acetone per formare perossido di acetone. Il perossido di acetone è un esplosivo ma non viene utilizzato in commercio perché è molto pericoloso da maneggiare. Più precisamente, il perossido di acetone è indicato anche come triperossido di triacetone, abbreviato TATP. Altri esplosivi a base di perossido di idrogeno includono esametilene triperossido diammina (HMTD).
Secondo gli esperti del Fraunhofer Institute for Chemical Technology, il TATP è utilizzato nella maggior parte degli attentati suicidi in Israele. Gli attentati del 7 luglio 2005 alla metropolitana di Londra (55 morti) sarebbero stati perpetrati anche con il TATP. Infine, il 4 settembre 2007, tre islamisti formati in Pakistan sono stati arrestati a Oberschledorn, Sauerland, che volevano produrre TATP da 730 chilogrammi di una soluzione di perossido di idrogeno al 35% per attaccare strutture e ristoranti statunitensi in Germania frequentati da cittadini statunitensi.
D'altra parte, gli esperti non sanno nel dettaglio come i terroristi possano far esplodere in modo controllato il TATP fatto con perossido di idrogeno. In particolare, in un tentativo sventato di contrabbandare esplosivi liquidi su un aeroplano a Londra nel 2007, è stato chiesto se si potesse produrre a bordo un perossido di acetone adatto utilizzando bottiglie di contrabbando di perossido di idrogeno e acetone.
Riferimenti
- Werner R. Thiel:Nuove vie per il perossido di idrogeno:alternative ai processi consolidati? Angewandte Chemie 111(21), pp. 3349-3351 (1999)
- Heribert Offermanns, Gunther Dittrich, Norbert Steiner:Il perossido di idrogeno nella protezione e sintesi ambientale . La chimica nel nostro tempo 34(3), pp. 150–159 (2000), ISSN 0009-2851
Riferimenti
- ↑ Voce su Perossido di idrogeno nel database delle sostanze GESTIS della BGIA, recuperato il 16/11/2007 (JavaScript richiesto)
- ↑ Süddeutsche Zeitung del 6 settembre 2007, p. 2:"Enciclopedia attuale:perossido di idrogeno “. Firmato:mkf
- ↑ Le informazioni in questo paragrafo si basano su quelle di mkf articolo firmato "Enciclopedia attuale:Perossido di idrogeno “ a pagina 2 della Süddeutsche Zeitung dal 6.9.2007.
- ↑ Süddeutsche Zeitung del 6 settembre 2007, p.1f.
- ↑ netzeitung.de
- ↑ Rundschau-online.de
- ↑ Questo paragrafo si riferisce a oraclesyndicate - Karl Weiss e all'articolo di Wikipedia Acetone Peroxide.