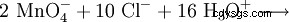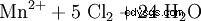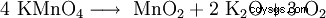| formula strutturale | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Generale | |||||||||
| Nome | Permanganato di potassio | ||||||||
| Altri nomi | tetraossomanganato di potassio (VII), manganato di potassio (VII), permanganato di potassio (um) | ||||||||
| Formula molecolare | KMnO4 | ||||||||
| Numero CAS | 7722-64-7 | ||||||||
| Breve descrizione | cristalli viola scuro con riflessi metallici | ||||||||
| Proprietà | |||||||||
| Massa molare | 158,03 g mol | ||||||||
| Stato della materia | risolto | ||||||||
| Densità | 2,70 g cm | ||||||||
| Punto di fusione | Decomposizione sopra 240 °C | ||||||||
| Punto di ebollizione | Non applicabile | ||||||||
| Pressione di vapore | 0,01 mbar (a 20 °C) | ||||||||
| Solubilità | moderata in acqua (64 g/L a 20 °C) | ||||||||
| Istruzioni di sicurezza | |||||||||
| |||||||||
| MAC | 0,5 mg m | ||||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||||
Permanganato di potassio (KMnO4 ) è il sale di potassio dell'acido permanganico, HMnO4, sconosciuto allo stato libero . È un solido cristallino di lucentezza metallica rosso-viola intenso e un forte ossidante. L'anione permanganato è l'unico responsabile del colore intenso del sale. È dovuto alla formazione di un complesso di trasferimento di carica. Nei permanganati, il manganese è nel suo più alto stato di ossidazione, VII.
Proprietà
Il permanganato di potassio forma cristalli lucidi di colore rosso-viola scuro che sono moderatamente solubili in acqua e producono una soluzione intensamente viola anche a basse concentrazioni. Quando riscaldati, i cristalli non si sciolgono, ma si disintegrano con un notevole crepitio, rilasciando ossigeno. Il permanganato di potassio cristallino è stabile a temperatura ambiente, ma le sue soluzioni acquose si degradano nel tempo.
Poiché il manganese è presente nel suo più alto stato di ossidazione nell'anione permanganato, si presenta come un agente ossidante molto forte nelle reazioni redox. Ad esempio, il permanganato di potassio ossida l'acido cloridrico in cloro gassoso (metodo di laboratorio per la preparazione del cloro):
Inoltre, ossida, ad esempio, solfiti in solfati, ioni Fe(II) in Fe(III), alcoli in acidi carbossilici. Può anche causare la decomposizione di [[Chimica organica|organica]. Il permanganato di potassio è ossidante.
Il permanganato di potassio si decompone da 240 °C a biossido di manganese (MnO2 ), ossido di potassio (K2 O) e ossigeno (O2 ):
In quanto complesso con eteri corona, il permanganato di potassio può essere reso disponibile anche in solventi organici non polari come il benzene o il toluene, che viene sfruttato nella chimica organica sintetica.
Produzione
La produzione tecnica parte dal biossido di manganese MnO2 con idrossido di potassio e ossigeno atmosferico per formare il manganato di potassio di colore verde (VI) K2 MnO4 reagito. Questo viene ulteriormente elaborato elettrochimicamente per formare permanganato di potassio (ossidazione anodica) e venduto in forma cristallina.
Utilizzo
Per il suo forte effetto ossidante, il permanganato di potassio viene utilizzato, tra l'altro, come disinfettante, deodorante e alghicida. Nell'analisi chimica quantitativa (ossidimetria, manganometria, una titolazione redox) viene utilizzata per determinare un gran numero di sostanze (es. ferro, nitrito, ossalato e indirettamente anche calcio); qui il punto finale della determinazione è indicato dal colore viola. In laboratorio, la soluzione alcalina di permanganato di potassio viene utilizzata anche per pulire la vetreria. In fotografia viene utilizzato per rilevare il sale di fissaggio (tiosolfato di sodio) e per ridurre le immagini sovraesposte; questo ossida l'argento.
Quando la glicerina viene fatta cadere su un eccesso di sale, la miscela si accende dopo alcuni secondi o minuti e brucia con una caratteristica fiamma viola. Questa reazione ritardata è stata utilizzata per avviare reazioni di termite a causa del calore intenso.
Medicina
In medicina, la soluzione di permanganato di potassio viene utilizzata come astringente e disinfettante per il trattamento esterno della pelle, ad es. per il piede d'atleta o dermatite da pannolino (codice ATC D08AX06). In Tossicologia di emergenza, bordeaux La soluzione di permanganato di potassio (circa 0,1%) viene utilizzata per la lavanda gastrica in caso di avvelenamento dopo l'ingestione di tossine ossidabili.
Storico
I fotografi del passato usavano il permanganato di potassio come componente delle polveri flash. Il permanganato di potassio veniva usato per fare i gargarismi contro il mal di gola e in cucina per deodorare la carne raffermo e renderla di nuovo commestibile.
Istruzioni di sicurezza
Il permanganato di potassio ha classe di pericolosità per l'acqua 3 (altamente pericoloso per l'acqua), che, oltre al suo effetto ossidante, deve essere tenuto in considerazione nello smaltimento dei residui di permanganato. Il permanganato di potassio è di bassa tossicità acuta (LD50 (ratto, orale) =750 mg/kg), ma ha un pronunciato effetto irritante sui tessuti viventi a causa del suo forte effetto ossidante, per cui si verificano facilmente ustioni chimiche. Va quindi evitato qualsiasi contatto che non sia l'uso medico o anche l'assunzione orale! La polvere di permanganato provoca opacità della cornea.
Lo scolorimento della pelle stessa, che si verifica al contatto, è invece innocuo ed è causato dal biossido di manganese formatosi durante la riduzione del permanganato. Le aree scolorite più grandi possono essere nuovamente sbiancate con soluzioni di solfiti.
A causa del suo forte effetto ossidante, il permanganato di potassio reagisce violentemente con molte sostanze riducenti o combustibili e può verificarsi l'autoaccensione. Le miscele con tali sostanze che non provocano una reazione spontanea sono estremamente infiammabili e possono quindi reagire in modo esplosivo.
Fonti
- ↑ Voce per CAS n. 6487-48-5 nel database delle sostanze GESTIS del BGIA, recuperato il 15 dicembre 2007 (JavaScript richiesto)
- ↑ Roth, Daunderer, Kormann:piante tossiche - tossine vegetali, ecomed Landsberg, 1988, ISBN 3-609-64810-4 , pag.810 e seguenti