| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| 2+ | |||||||
| Generale | |||||||
| Nome | carbonato di ammonio | ||||||
| Altri nomi | ammonio carbonato, sale di cervo | ||||||
| Formula molecolare | (NH4 )2 CO3 | ||||||
| Numero CAS | 10361-29-2 | ||||||
| Breve descrizione | solido incolore | ||||||
| Proprietà | |||||||
| Massa molare | 96,09 g mol | ||||||
| Stato della materia | risolto | ||||||
| Densità | 1,6 g cm | ||||||
| Punto di fusione | si decompone a 58 °C | ||||||
| Punto di ebollizione | decade prima | ||||||
| Pressione di vapore | 0,69Pa (20°C) | ||||||
| Solubilità | buono in acqua | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
carbonato di ammonio , (NH4 )2 CO3 H2 O, forma cristalli cubici solubili in acqua, incolori, con peso molecolare Mr dal 114.10. Si decompone completamente in ammoniaca, anidride carbonica e acqua a 58 °C.
Proprietà
Il sale forma una polvere incolore con un debole odore di ammoniaca. Ha una densità di circa 1,6 g cm (a 20 °C) e un'elevata solubilità in acqua di circa 220 g/L. La soluzione reagisce debolmente alcalina, si stabilisce un equilibrio tra ammoniaca NH3 , ioni ammonio NH4 , ioni carbonato CO3 , ioni di idrogenocarbonato HCO3 e anidride carbonica CO2 a.
Il sale quindi reagisce con acqua e acido carbonico per formare idrogeno carbonato e ioni idrossido. Una soluzione acquosa di carbonato di ammonio è quindi stabile solo in un ambiente neutro e debolmente basico:il gas di anidride carbonica fuoriesce negli acidi e il gas di ammoniaca negli alcali concentrati.
Sintesi
Il carbonato di ammonio può essere preparato facendo reagire l'anidride carbonica con l'ammoniaca in una soluzione acquosa.
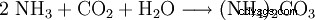
Un altro modo per mostrarlo è riscaldare il carbonato di calcio insieme al solfato di ammonio.

Con quest'ultimo metodo, il bicarbonato di ammonio e il carbammato di ammonio sublimano oltre al carbonato di ammonio desiderato, lasciando il solfato di calcio come solido.
Utilizzo
Il carbonato di ammonio viene utilizzato nella sintesi di eterocicli e come additivo negli sviluppatori fotografici. Viene utilizzato anche in tintura, come generatore di anidride carbonica negli estintori e come sale odoroso.
Viene anche usato come agente lievitante (noto anche come sale di staghorn).Nell'UE è numerato E 503i come additivo alimentare approvato.
Il carbonato di ammonio è spesso utilizzato nella chimica inorganica per un'analisi qualitativa al fine di precipitare i cationi di metalli alcalino terrosi di bario, stronzio e calcio da un campione sconosciuto come gruppo, separarli e identificarli con l'aiuto di reazioni di rilevamento.

