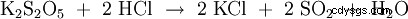| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
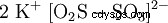 | |||||||
| Generale | |||||||
| Nome | Disolfito di potassio | ||||||
| Altri nomi |
| ||||||
| Formula molecolare | K2 S2 O5 | ||||||
| Numero CAS | 16731-55-8 | ||||||
| Breve descrizione | polvere incolore (bianca) che odora di anidride solforosa | ||||||
| Proprietà | |||||||
| Massa molare | 222,33 g mol | ||||||
| Stato della materia | risolto | ||||||
| Densità | 2,34 g cm | ||||||
| Punto di fusione | 190 °C (decomposizione) | ||||||
| Punto di ebollizione | Non applicabile | ||||||
| Solubilità | 450 g/l (20 ºC) in acqua, insolubile in alcool | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| LD50 | 2300 mg/kg (orale, ratto) | ||||||
| WGK | 1 (leggermente pericoloso per l'acqua) | ||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
Disolfito di potassio (K2 S2 O5 ) o metabisolfito di potassio , Pirosolfito di potassio chiamato, è un sale di potassio dell'acido disolfuro, che non è stabile nella forma libera. I disolfiti hanno un legame zolfo-zolfo abbastanza lungo e instabile. Il disolfito di potassio è utilizzato principalmente come conservante (E 224) nell'industria alimentare. In condizioni acide, il composto scinde l'anidride solforosa:
Ottenere e visualizzare
Viene prodotto per dimerizzazione termica (condensazione) dell'idrogeno solfito di potassio con eliminazione dell'acqua (1), oppure per reazione di anidride solforosa e solfito di potassio in soluzione di idrossido di potassio (2):
- (1)
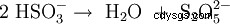
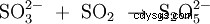
Utilizzo
L'additivo alimentare disolfito di potassio (E 224) è utilizzato come conservante, antiossidante e stabilizzante del colore negli alimenti (ad esempio anche nella solforazione del vino).
È anche comunemente usato come agente riducente nell'industria chimica, per sbiancare lo zucchero, come caustico nell'industria elettronica e come componente di fissativi nell'industria fotografica.
Riferimenti
- ↑ pericoloso-materials-data.de [1]
- ↑ inorganics.basf.com [2]
- ↑ Merck - ChemDAT.info [3]
- ↑ metallograf.de [4]