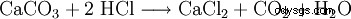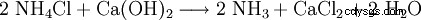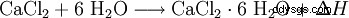| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| Nessuna formula strutturale disponibile | |||||||
| Generale | |||||||
| Nome | cloruro di calcio | ||||||
| Altri nomi |
| ||||||
| Formula molecolare | CaCl2 | ||||||
| Numero CAS | 10043-52-4 (anidro) 10035-04-8 (diidrato) 25094-02-4 (tetraidrato) 07774-34-7 (esaidrato) | ||||||
| Breve descrizione | cristalli igroscopici incolori e inodori | ||||||
| Proprietà | |||||||
| Massa molare | 110,98 g mol (anidro) 147,02 g mol (diidrato) 182,04 g mol (tetraidrato) 219,08 g mol (esaidrato) | ||||||
| Stato della materia | risolto | ||||||
| Densità | 2,16 g cm (anidro) 1,85 g cm (diidrato) 1,71 g cm (esaidrato) | ||||||
| Punto di fusione | 782 °C (anidro) ca. 176 °C (diidrato) ca. 35 °C (tetraidrato) | ||||||
| Punto di ebollizione | 1935 °C | ||||||
| Pressione di vapore | 11 hPa | ||||||
| Solubilità |
facilmente solubile in acqua:740 g l (20 °C) | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
| Struttura cristallina ||Rutile (distorto), ottaedricocloruro di calcio (anche cloruro di calcio ) è un cloruro del calcio metallico alcalino terroso con formula molecolare CaCl2 . Il calcio ha lo stato di ossidazione +2, il cloro ha lo stato di ossidazione −1.
Cronologia
Intorno al 1860, i chimici Robert Wilhelm Bunsen e Matthiessen riuscirono nella prima preparazione pura dell'elemento calcio attraverso l'elettrolisi del cloruro di calcio.
Occorrenze
Il cloruro di calcio si trova in natura disciolto in salamoia.
Ottenere e visualizzare
Il cloruro di calcio è costituito da acido cloridrico e carbonato di calcio:
Il successivo riscaldamento a 260 °C fornisce la forma anidra.
Tecnicamente il cloruro di calcio si ottiene come prodotto di scarto dalla produzione della soda con il processo Solvay, ovvero quando l'ammoniaca viene recuperata dal cloruro di ammonio che si produce:
Proprietà
Il cloruro di calcio è un sale. Calcio e cloro esistono come ioni a causa della grande differenza di elettronegatività. Il legame avviene quindi tramite interazioni elettrostatiche.
Nella sua forma pura, il cloruro di calcio forma cristalli incolori ed è altamente igroscopico quando è anidro. Assorbe facilmente l'acqua dall'ambiente circostante, formando un complesso di idrati.
Reazioni
Il cloruro di calcio reagisce con l'acqua per formare un complesso esaidrato e sviluppa molto calore (esotermico, ΔH> 0):
I cristalli dell'esaidrato si sciolgono nella propria acqua di cristallizzazione a circa 30 °C. L'acqua legata viene rilasciata nuovamente riscaldandola a circa 200 °C. La dissoluzione in acqua, contrariamente al cloruro di calcio anidro, porta ad un forte raffreddamento. Entrambe le forme di cloruro di calcio sono anche facilmente solubili in etanolo.
Utilizzo
Grazie alla sua igroscopia, il cloruro di calcio anidro è un importante agente essiccante in laboratorio, ad esempio nell'essiccatore, e nella chimica tecnica per un'ampia varietà di gas e liquidi. Campi di applicazione sono l'essiccazione di ambienti abitativi, l'impiego come antigelo, in particolare come antigelo e accelerante di presa nel calcestruzzo, e come legante della polvere (es. nei cantieri). In medicina, è usato per fermare l'emorragia e per curare malattie da carenza di calcio, nonché per curare geloni e allergie.
Viene utilizzato come agente rassodante, esaltatore di sapidità e stabilizzante (ad es. nel trattamento dell'acqua potabile, nel trattamento superficiale della frutta).Nell'UE è numerato E 509 come additivo alimentare approvato.
Il cloruro di calcio viene utilizzato per riscaldare bevande pronte da bere sfruttando l'idratazione esotermica quando reagisce con l'acqua, viene utilizzato anche come sale stradale e per la produzione di miscele refrigeranti (vedi sopra ).
Viene anche utilizzato per coagulare le proteine nella tecnologia alimentare e nella fabbricazione di prodotti come il tofu o il caviale artificiale.
Fonti
- ↑ Database delle sostanze BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 9 maggio. 2007