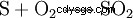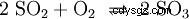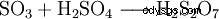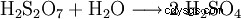| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Général | |||||||
| Nom | Acide sulfurique | ||||||
| Autres noms | |||||||
| Formule moléculaire | H2 SO4 | ||||||
| Numéro CAS | 7664-93-9 | ||||||
| Brève description | liquide incolore et inodore, légèrement visqueux | ||||||
| Propriétés | |||||||
| Masse molaire | 98,08 g mol | ||||||
| État de la matière | liquide | ||||||
| Densité | 1.8356g cm | ||||||
| Point de fusion | 10,38 °C | ||||||
| Point d'ébullition | 279,6 °C | ||||||
| Pression de vapeur | |||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| MAK | |||||||
| LD50 | |||||||
| WGK | 1 - légèrement dangereux pour l'eau | ||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Acide sulfurique (selon IUPAC :Dihydrogensulfat ) est un liquide visqueux incolore et un acide inorganique fort. C'est l'un des acides minéraux et l'un des 20 produits chimiques les plus importants de l'industrie chimique. En tant qu'additif alimentaire, il porte le numéro E 513 .Acide sulfurique dilué est appelé acide dilué. Jusqu'au 19e siècle, l'acide sulfurique portait également le nom trivial d'huile de vitriol (dérivée de vitriols), qui n'est plus utilisé aujourd'hui.
Les sels et esters de l'acide sulfurique sont appelés sulfates et hydrogénosulfates. Les sulfates de type sel contiennent l'ion sulfate (SO4 ).
Obtenir et afficher
Dans le passé, l'acide sulfurique était produit à l'aide du procédé au vitriol et du procédé à chambre de plomb. Les méthodes modernes sont la méthode de contact et la méthode de double contact développée à partir de celle-ci.
Le procédé le plus ancien de production d'acide sulfurique est le procédé au vitriol. Il était utilisé par les alchimistes au XIIIe siècle. Les vitriols sont des sulfates relativement faciles à décomposer thermiquement pour former du trioxyde de soufre et un oxyde métallique. Johann Rudolph Glauber (1604–1670) a construit la première usine d'acide sulfurique au monde, qui a utilisé ce procédé pour produire de l'acide sulfurique vers 1650 à Nordhausen (Harz).
Dans le processus de contact, la production se déroule en trois étapes, en commençant par le soufre élémentaire (S) et l'oxygène (O2 ) Dioxyde de soufre (SO2 ) s'affiche :
Le dioxyde de soufre est ensuite oxygéné avec du pentoxyde de vanadium (V2 O5 ) comme catalyseur, au trioxyde de soufre (SO3 ) implémenté :
Le trioxyde de soufre est l'anhydride de l'acide sulfurique. En raison de sa faible solubilité dans l'eau, il n'est pas introduit directement dans l'eau mais dans l'acide sulfurique concentré, par lequel il est très bien absorbé.
L'acide disulfurique formé est continuellement dilué avec de l'eau.
Propriétés
Acide sulfurique avec la formule moléculaire H2 SO4 est un acide fort (pKS1 =−3, pKS2 , qui correspond au pKS de l'anion sulfate d'hydrogène HSO4 =1,9). En tant qu'acide inorganique fort, il fait partie des acides minéraux. L'acide sulfurique concentré est également un puissant agent oxydant. Il est également hygroscopique et peut donc être utilisé pour sécher des gaz et des liquides. La molécule d'acide sulfurique tétraédrique déformée a un grand moment dipolaire, dont le pôle positif se situe entre les deux groupes OH.
L'acide sulfurique forme un azéotrope avec l'eau. Si de l'acide sulfurique à 100 % est porté à ébullition, le trioxyde de soufre s'évapore jusqu'à atteindre une concentration d'environ 98 % en poids. Inversement, l'acide sulfurique dilué peut être amené à cette concentration en le faisant bouillir.
L'acide sulfurique à 100% est préparé en faisant barboter du trioxyde de soufre dans environ 98% en poids d'acide sulfurique jusqu'à ce qu'il soit anhydre. L'acide sulfurique peut également lier de grandes quantités de trioxyde de soufre, le liquide résultant est appelé oléum en raison de sa viscosité élevée. L'oléum est constitué d'un mélange d'acide sulfurique et d'acides polysulfuriques (acide disulfurique :H2 S2 O7 , acide trisulfurique H2 S3 O10 , etc.) L'oléum contenant jusqu'à 65 % en poids de trioxyde de soufre est disponible dans le commerce. L'oléum est utilisé dans les réactions chimiques pour la sulfonation ou lorsqu'il est nécessaire de lier autant d'eau que possible de la réaction. Cela minimise la consommation d'acide sulfurique et maximise souvent le rendement.
Pour déterminer la concentration, la densité de l'acide sulfurique est mesurée. La concentration peut ainsi être directement déduite des tables standards. Par exemple, l'état de charge d'une batterie de voiture est déterminé (voir aussi batterie au plomb).
Lors de la dilution d'acide sulfurique concentré, beaucoup de chaleur est dégagée. Par conséquent, des mesures de précaution appropriées doivent être prises. Il est important que toujours l'acide l'eau est mélangé, c'est-à-dire pas l'eau de l'acide ! Sinon, l'eau peut s'évaporer de manière explosive, provoquant un jaillissement incontrôlable du liquide; le danger est évident. Le mnémonique :"D'abord l'eau, puis l'acide, sinon le monstrueux arrivera."
Signification et utilisation
L'acide sulfurique est l'un des produits chimiques les plus couramment produits. En 1997, plus de 130 millions de tonnes ont été produites dans le monde. Les applications possibles sont très diverses. L'acide sulfurique est utilisé
- pour la digestion de minerais (par exemple, dans la digestion d'oxyde de titane(IV) ou d'uranium)
- pour la production de sulfates
- pour la production d'autres acides (par exemple, acide fluorhydrique ou acide phosphorique)
- pour la production d'engrais via l'acide nitrique
- pour la production de tensioactifs
- comme catalyseur
- pour le traitement des métaux
- comme déshydratant
- comme adjuvant de réaction (acide nitrant)
- dans les batteries de voiture
- pour graver les semi-conducteurs
- en raison de sa conductivité en tant qu'additif pour l'eau dans l'électrolyse
- comme solvant pour fumer
- en analyse pour déterminer les indices de viscosité du polyamide
- pour la production de dioxyde de titane
Dans l'industrie alimentaire, l'acide sulfurique est utilisé comme additif technique pour produire de l'amidon modifié et de la caséine et pour traiter l'eau potable. Il ne s'écoule pas dans le produit final et n'est donc pas présent ou n'est présent que sous forme de traces inoffensives pour la santé. Dans l'Union européenne, l'acide sulfurique n'a pas à être déclaré sur l'emballage du produit.
La dissolution du permanganate de potassium dans l'acide sulfurique jusqu'à saturation produit un liquide huileux vert foncé (heptoxyde de dimanganèse) qui est un agent oxydant puissant. Il carbonise immédiatement les matériaux organiques tels que le bois et s'enflamme spontanément avec de l'acétone ou d'autres combustibles. En dissolvant du dichromate de potassium dans de l'acide sulfurique, on obtient de l'acide sulfurique chromique, une substance couramment utilisée dans le passé à des fins de nettoyage dans les laboratoires.
La quantité d'acide sulfurique produite était un indicateur de l'efficacité de l'industrie chimique d'un pays. De grandes quantités d'acide sulfurique sont consommées dans la phase II de développement de l'industrie chimique.
Phases de développement :
- I. Consommation prédominante de soude caustique
- II. Consommation prédominante d'acide sulfurique III. consommation de chlore courante
Structure et collage
Dans la molécule d'acide sulfurique, comme dans l'anion sulfate d'hydrogène, l'atome de soufre a une coordination tétraédrique déformée. Les deux liaisons S-O aux groupes OH sont sensiblement plus longues qu'aux deux atomes d'oxygène "nus". Les longueurs de liaison trouvées correspondent aux ordres de liaison de 1 et 2. Dans la notation fréquemment utilisée avec des doubles liaisons (covalentes) et sans charges formelles, cependant, la liaison des quatre atomes d'oxygène au soufre ne peut être expliquée sans utiliser les orbitales 3d de le soufre pour les liaisons π soit utilisé (cf. PSE). Cependant, des considérations théoriques détaillées montrent que les orbitales d contribuent peu à la liaison dans les composés des éléments du groupe principal. La liaison la plus courte aux atomes d'oxygène "nus" est donc mieux décrite comme une simple liaison covalente, qui est raccourcie par des interactions électrostatiques supplémentaires. La séparation de charge peut être dérivée de la structure de frontière mésomérique unique qui obéit à la règle de l'octet.
Preuve
L'acide sulfurique peut être détecté sous la forme de l'anion sulfate. Par exemple, la précipitation sous forme de sulfate de baryum microcristallin peu soluble après addition d'une solution de chlorure de baryum sert de détection de sulfate.
Connexions importantes
Sels :
- Sulfate de cuivre (vitriol de cuivre)
- Sulfate de calcium (gypse, albâtre, anhydrite) (CaSO4 )
- Sulfate de baryum (barytine, spath lourd) (BaSO4 )
- Alun (sulfates d'aluminium mélangés avec d'autres cations)
- Aluminite
- Sulfate ferreux (vitriol ferreux)
- Sulfate de sodium (sel de Glauber)
Ester :
- sulfate de diméthyle (solvant, agent de méthylation ; très toxique)
Origine
- ↑ Entrée sur l'acide sulfurique dans la base de données des substances GESTIS du BGIA, récupérée le 31 mars 2007 (JavaScript requis)
- Acide sulfureux H2 SO3 (sulfite de dihydrogène)
- Point de rosée de l'acide sulfurique