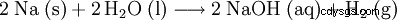| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Général | |||||||
| Nom | Hydroxyde de sodium | ||||||
| Autres noms | |||||||
| Formule moléculaire | NaOH | ||||||
| Numéro CAS | 1310-73-2 | ||||||
| Brève description | solide cristallin blanc, souvent sous forme de pastilles | ||||||
| Propriétés | |||||||
| Masse molaire | 39,997 g mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 2 130 g cm | ||||||
| Point de fusion | 322 °C | ||||||
| Point d'ébullition | 1388 °C | ||||||
| Pression de vapeur | |||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| MAK | |||||||
| WGK | 1 – légèrement dangereux pour l'eau | ||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Hydroxyde de sodium (également soude caustique , soude caustique ), formule chimique NaOH , est un solide blanc hygroscopique. Il se dissout dans l'eau en générant de grandes quantités de chaleur pour donner de la soude caustique fortement alcaline (pH environ 14 à c =1 mol/l). Il réagit avec le dioxyde de carbone de l'air pour former du carbonate de sodium et est donc stocké dans des contenants hermétiques. Pour empêcher l'hydroxyde de sodium de lier l'eau de l'air, il peut être stocké avec un déshydratant. En tant que base forte, il déplace les bases plus faibles et plus volatiles de leurs sels.
La production mondiale en 2001 était de 46 millions de tonnes.
Fabrication
- Réaction du carbonate de sodium avec l'hydroxyde de calcium pour former de l'hydroxyde de sodium et du carbonate de calcium :
Le carbonate de calcium peu soluble est filtré. L'hydroxyde de sodium facilement soluble reste dans le filtrat.
- Électrolyse du chlorure de sodium en soude caustique, hydrogène et chlore gazeux (électrolyse chloralcali).
Il existe plusieurs procédés industriels :
- Procédure d'amalgame
- Procédure de diaphragme
- processus membranaire
(voir aussi électrolyse chlore-alcali)
Tous les procédés ont en commun des étapes supplémentaires de purification et de concentration pour obtenir de l'hydroxyde de sodium anhydre.
- L'hydroxyde de sodium peut être obtenu en laboratoire en faisant réagir du sodium élémentaire avec de l'eau pour former de la soude caustique et de l'hydrogène :
- Après évaporation de la soude caustique, il reste de l'hydroxyde de sodium solide :
Utilisation
- Production de savons divers (soude caustique)
- Production de colorants (soude caustique)
- Production de cellulose à partir de bois et de paille
- Mercerisage du coton
- Nettoyage de la graisse, de l'huile et du pétrole
- Digestion de bauxite (précurseur dans la production d'aluminium)
- Synthèse de divers produits chimiques (par exemple, hypochlorite de sodium, phosphate de sodium, sulfure de sodium, aluminate de sodium)
- Synthèse de l'acide formique
- Production d'eau déminéralisée :régénération des échangeurs d'ions
- Développement de matériaux de cartes de circuits imprimés exposés dans l'électronique (environ 10 g/l à 20 °C)
- Fait partie des nettoyeurs de canalisations
- Confectionner des bretzels pour la coloration brune et le goût "savonneuse"
- Régénération de déioniseurs pour les besoins des laboratoires et des aquariums
- Gravure de plaques de laiton, de maillechort et de cuivre pour le maquettiste
- Détermination de l'acidité du vin à l'aide de lessive bleue
- Nettoyage des réservoirs en acier inoxydable
- Enlever l'ancienne peinture (décapage)
- Pour lisser les cheveux crépus (défrisant)
- Locomotive Natron
- Détection de tous les composés organiques azotés ("Manute detection")
- Enlèvement de la peau des fruits et légumes (!) lors de la transformation industrielle
- agent de trempe dissous dans l'eau pour durcir l'acier
Exemple expérimental
Si vous ajoutez un peu d'hydroxyde de sodium à l'eau, puis remuez, la solution se réchauffera. Cela convient comme exemple simple d'un processus de solution exothermique utilisé à l'école, par exemple. L'effet inverse, un processus de dissolution endothermique, peut être observé lors de la dissolution du nitrate de potassium ou du nitrate d'ammonium dans l'eau, l'effet étant beaucoup plus fort lors de la dissolution du nitrate d'ammonium (baisse de température d'environ 10 K).
Origine
- ↑ Base de données des substances BGIA GESTIS :https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 15 février 2007
- Sodium