| structure cristalline | |||||||
|---|---|---|---|---|---|---|---|
| Aucune formule structurelle disponible | |||||||
| Général | |||||||
| Nom | Oxyde de Magnésium | ||||||
| Autres noms | |||||||
| Formule de rapport | MgO | ||||||
| Numéro CAS | 1309-48-4 | ||||||
| Brève description | cristaux incolores | ||||||
| Propriétés | |||||||
| Masse molaire | 40 g/mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 3.65g cm | ||||||
| Point de fusion | ~2800 °C | ||||||
| Point d'ébullition | ~3600 °C | ||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Oxyde de magnésium (MgO ) ou la magnésie est un sel composé d'ions Mg et O. Il cristallise dans le réseau de chlorure de sodium.L'oxyde de magnésium est produit en brûlant du magnésium, il peut être obtenu par précipitation à partir d'eau de mer ou il peut être produit en chauffant un composé de magnésium (par exemple, l'hydroxyde de magnésium Mg(OH)2 ). ou carbonate de magnésium MgCO3 ).
Dans ce dernier cas, le comportement chimique de l'oxyde de magnésium dépend beaucoup de la température de production et du procédé de fabrication. Lorsque le carbonate de magnésium naturel (magnésite) est "brûlé" à environ 800 °C, ce que l'on appelle la "magnésite brûlée caustique" est produite. Le dioxyde de carbone s'échappe pendant le processus de cuisson, mais la température est trop basse pour permettre le frittage. Les grains d'oxyde de magnésium résultants ont donc toujours la forme extérieure du carbonate de magnésium, sont poreux et très réactifs en raison de la grande surface intérieure. Avec l'eau, l'hydroxyde de magnésium se forme en peu de temps. La réaction de certains sels de magnésium dissous dans l'eau avec de la magnésite brûlée caustique conduit à la cristallisation d'une masse dure comme la roche. Le sel de magnésium est-il du chlorure de magnésium MgCl2 , on parle de ciment de Sorel. Il est utilisé pour la fabrication de sols industriels. De plus, la magnésite brûlée caustique est utilisée dans l'industrie des engrais et des aliments pour animaux comme support de magnésium. L'oxyde de magnésium est également utilisé pour la thérapie de substitution.
Entre 1700 °C et 2000 °C, de la magnésie frittée se forme, au-dessus de 2800 °C de la magnésie fondue. Les deux variétés réagissent à peine avec l'eau. La magnésie frittée est utilisée pour les revêtements de fours et les équipements de laboratoire en raison de sa résistance au feu (point de fusion 2800 °C). La magnésie est utilisée dans la production de réfractaires de base pour la production de ciment, l'extraction de métaux non ferreux, les affineurs d'acier et le verre, et la fabrication de briques de magnésie-carbone, principal matériau utilisé dans la fabrication de revêtements réfractaires pour les cuves sidérurgiques (convertisseur, four à arc électrique et poche). Sans magnésie, ces matériaux ne peuvent pas être fabriqués à l'aide de méthodes modernes. Ce matériau était également utilisé dans le passé pour isoler les tubes entre le filament et la cathode des tubes électroniques en raison de sa résistance à la chaleur.
L'oxyde de magnésium est naturellement présent sous la forme d'un minéral volcanique périclase avant de. Ce sont des cristaux réguliers gris à vert foncé, vitreux, d'une dureté de 5,5 à 6.
Il est ajouté aux aliments en tant que régulateur d'acidité ou anti-agglomérant. Il est classé comme additif alimentaire E 530 dans l'UE. sans limite maximale (quantum satis ) généralement approuvé pour l'alimentation.
Fabrication
Il existe plusieurs façons de produire de l'oxyde de magnésium :
La vapeur d'éthanol (lorsqu'elle est chauffée) réagit avec le magnésium pour former de l'oxyde de magnésium et de l'éthane :
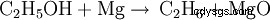
Lorsque le magnésium brûle dans l'air, il réagit avec l'oxygène pour former de l'oxyde de magnésium :
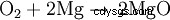
Preuves individuelles
- ↑ ChemDat de Merck, Version 2.13.2, 2005
