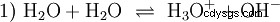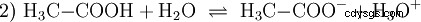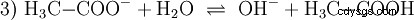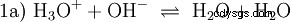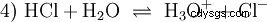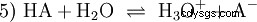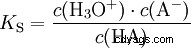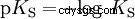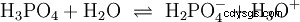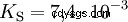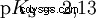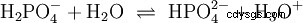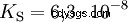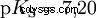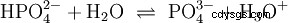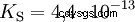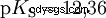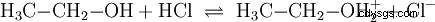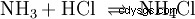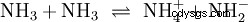acides sont, au sens le plus étroit, tous les composés capables de transférer des protons (H) à un partenaire de réaction - ils peuvent agir comme donneur de protons. En solution aqueuse, le réactif est essentiellement de l'eau. Ions oxonium (H3 O), le pH de la solution est ainsi abaissé. Les acides réagissent avec les soi-disant bases pour former de l'eau et des sels. Une base est donc l'opposé d'un acide et est capable de le neutraliser.
Dans un sens plus large, différents concepts acide-base décrivent des ensembles beaucoup plus larges de réactions chimiques qui peuvent aller bien au-delà des réactions mentionnées ci-dessus.
Développement historique des acides
Probablement le plus ancien acide connu (lat. acidum ) est du vinaigre (lat. acetum ), une solution aqueuse à environ 5% du composé acide acétique. Les acides ressemblaient à du vinaigre (oxo ou acide ). En alchimie, l'acide était considéré comme une substance primordiale . Les propriétés acides étaient basées sur un seul acide urique , qui est entré en vigueur dans diverses substances. Les acides font mousser la chaux ou les carbonates, ont un effet caustique et un goût de brûlé. Hormis le vinaigre et d'autres jus de plantes, aucun acide n'était connu jusqu'à la fin du XIIIe siècle. Une connaissance étendue des acides a été attribuée à Geber, qui a vécu au 8ème siècle, mais elle est basée sur des écrits de beaucoup plus jeunes, soi-disant pseudo-Geber [1]. Connaissance de divers acides inorganiques développés, qui sont tous des variétés de l'élément eau ont été attribués. Dès le 18ème siècle, ils étaient appelés acides minéraux.
- Une production d'acide nitrique (HNO3 ) était probablement utilisée par les pseudo-donneurs après le XIIIe siècle comme eau dissolvante (aqua dissolutiva ) ou eau forte (aqua fortis ) décrit. Le vitriol de cuivre était chauffé au rouge avec du salpêtre et de l'alun. Des gaz nitreux s'échappent, qui forment de l'acide nitrique avec l'eau. Cet acide était aussi appelé eau de séparation , car il dissout l'argent dans une réaction chimique mais pas l'or. En 1648, J. R. Glauber décrit la production d'acide nitrique concentré (fumant) (spiritus acidus nitri ) par réaction avec de l'acide sulfurique.
- L'eau régale, du point de vue actuel un mélange d'acide nitrique et d'acide chlorhydrique, était probablement connue très tôt, car elle peut être obtenue relativement facilement en faisant réagir l'acide nitrique avec le sel ammoniac bien connu. L'eau régale était la reine de tous les acides , pas même l'or, le roi des métaux , pourrait résister.
- Acide sulfureux (H2 SO3 ) est certainement connu depuis longtemps, puisqu'il peut être obtenu en brûlant du soufre élémentaire. L'acide sulfurique était certainement également présent dans de nombreux procédés. Des procédés plus détaillés de préparation d'acide sulfurique (H2 SO4 ) ont été décrites pour la première fois plus en détail par A. Libavius en 1597 :a) recuit de sulfate de fer ou de cuivre avec des vitrioles (Oleum vitrioli , acide sulfurique fumant) et b) combustion du soufre et oxydation subséquente donnant des solutions diluées (Oleum sulphuris ) LED. Une mise en œuvre technique aboutit au XIXe siècle avec le procédé à chambre de plomb.
- L'acide chlorhydrique (HCl) en tant que composé indépendant n'est devenu connu qu'à la fin du XVIe siècle. A. Libavius a décrit une synthèse en enflammant un mélange de sel commun et d'argile. B. Valentinus a décrit la conversion du vitriol et du sel commun en aqua caustica , l'eau corrosive. Des enquêtes intensives menées par J. R. Glauber au 17ème siècle ont conduit au fantôme du sel de Glauber (Spiritus salis Faithrianus ) du très concentré, dit fumer l'acide chlorhydrique ou le chlorure d'hydrogène gazeux.
Le terme important de base en tant que contrepartie phénoménologique des acides a été utilisé au 17ème siècle par des alchimistes tels que G. E. Stahl, R. Boyle et GF Rouelle, car les substances "basiques" ont le caractère non volatil Base pour la fixation des acides volatils formé et peut neutraliser l'effet (corrosif) des acides. A. L. Lavoisier, qui a attribué certaines propriétés à certains composés chimiques, a fait des pas fondamentaux en chimie au XVIIIe siècle. Il pensait que les acides étaient toujours formés à partir d'oxydes non métalliques et d'eau, et les bases à partir d'oxydes métalliques et d'eau. J. von Liebig, quant à lui, considérait les acides comme des composés hydrogènes pouvant être transformés en sels par les métaux.
En 1887, S. Arrhenius a défini les acides comme des substances qui, lorsqu'elles sont dissoutes dans l'eau, libèrent des protons (H) et les bases comme des substances qui, lorsqu'elles sont dissoutes dans l'eau, libèrent des ions hydroxyde (OH). Lorsque les acides et les bases sont combinés, ils se neutralisent pour former de l'eau. Cependant, la théorie était encore insuffisante, puisque les composés sans oxygène n'étaient pas inclus :l'ammoniac neutralise également un acide. En 1923, JN Brønsted et T. Lowry ont décrit indépendamment ce qui est encore aujourd'hui la définition la plus importante des acides et des bases. Ils forment la base des explications acides ci-dessous.
Propriétés des acides
- Les acides attaquent particulièrement les métaux de base et la chaux. Mais les vêtements, la peau et les yeux (tous les matériaux organiques en général) sont également à risque en cas de contact. Mise en garde! Les brûlures chimiques peuvent toujours arriver. Portez des lunettes de sécurité !
- Il existe des acides forts et faibles. L'acide chlorhydrique est un acide fort. L'acide acétique est un acide moins fort et l'acide carbonique est un acide faible.
- Les acides peuvent être dilués avec de l'eau, mais leur effet devient nettement plus faible en fonction de la dilution. La dilution d'acides concentrés est une réaction exothermique. Une grande quantité de chaleur est générée et la solution acide peut gicler de manière incontrôlable. Par conséquent, lors de la dilution, la règle d'ajouter l'acide à l'eau s'applique, et non l'inverse :"D'abord l'eau, puis l'acide, sinon la chose monstrueuse se produira. "
- C'est un mensonge courant que les acides sont toujours des liquides. Les représentants bien connus des acides présents uniquement sous forme de solides sont la vitamine C et l'acide citrique.
- Les acides transforment le papier de tournesol bleu en rouge.
- Les "adversaires des acides" sont les bases (solution de base =lessive). Ils peuvent neutraliser les acides. Les bases sont également caustiques et attaquent de nombreuses autres substances qui ne réagissent pas nécessairement avec les acides.
- Les acides, lorsqu'ils sont dissous dans l'eau, conduisent l'électricité. Ici, une électrolyse a lieu, dans laquelle de l'hydrogène se forme à la cathode (le pôle -) et la substance neutralisée de l'ion résidu acide (anion acide) se forme à l'anode (le pôle +), par exemple du chlore dans le cas de acide hydrochlorique. La réduction (acceptation des électrons) se produit à la cathode et l'oxydation (perte d'électrons) se produit à l'anode.
Que sont les acides ?
Sans m'étendre sur les différents concepts acido-basiques une manière possible et commune de voir les choses doit être décrite ici en guise d'introduction. généralement est étroitement lié aux acides et souvent sans mention explicite la présence et certaines propriétés de l'eau. L'eau pure est sujette à ce qu'on appelle l'autoprotolyse. Les ions oxonium (H3) se forment à partir de l'eau en quantités très faibles et égales O) et des ions hydroxyde (OH) :
Cette équation de réaction de l'eau montre la propriété d'un acide, à savoir la capacité de former H3 ions O dans l'eau. Dans le même temps, des ions OH se forment dans l'eau. Une des qualités que peut avoir une base. Cependant, l'eau n'est ni une base ni un acide et leur comportement est dit neutre . Il s'agit du pH, qui est la concentration de H3 indique les ions O dans l'eau. L'eau pure a un pH de 7, une très petite concentration. Comme toutes les réactions décrites dans cette section, cette réaction est une réaction d'équilibre :la formation des ions et leur combinaison pour former de l'eau a lieu constamment et avec la même fréquence. Neutre ne veut pas dire que rien ne se passe.
Les acides sont des composés chimiques qui peuvent interagir avec l'eau d'une certaine manière. Ils ont des atomes d'hydrogène qui sont liés comme des ions (ionogènes). C'est ainsi que l'acide acétique pur (H3 C-COOH) avec de l'eau et forme plus de H3 ions O. Lorsqu'une telle réaction se produit, un composé peut être appelé un acide. En plus de l'ion oxonium, l'anion acétate H3 est également formé C-COO :
L'acide acétique est un acide carboxylique et un acide plutôt faible par rapport aux acides inorganiques tels que l'acide chlorhydrique. En solution aqueuse, une grande partie des molécules se trouvent non dissociées sous forme de H3 C-COOH avant. Là aussi, un équilibre s'établit rapidement. Pour cette raison, l'équation de réaction (2) ci-dessus peut être lue de droite à gauche avec une justification égale. Un anion acétate réagit avec un ion oxonium pour former de l'eau et de l'acide acétique. Dans ce sens de lecture, une réaction de base a lieu au lieu de cela :La conversion des ions hydroxonium en molécules d'eau. Si une quantité appropriée d'anions acétate, par exemple sous la forme d'acétate de sodium facilement soluble, est ajoutée à une solution d'acide acétique, la propriété acide de l'acide acétique peut être complètement compensée par la propriété basique de l'ion acétate. La solution aqueuse est neutralisée. Neutre ne signifie pas que rien ne se passe dans la solution. Seule la concentration du H3 Les ions O sont aussi bas que dans l'eau pure.
De plus, la réaction de base être pris en compte, ce qui se produit lorsque l'acétate de sodium est à l'état pur l'eau est dissoute :
Les ions hydroxyde (OH) se forment ici. L'ajout d'une quantité appropriée de solution aqueuse d'acide acétique à cette solution d'acétate rend la solution neutre . Il se situe entre H3 O et OH entrent dans l'équilibre (1) initialement présenté comme une propriété fondamentale de l'eau et représenté par l'équation (1a) inversée.
| Un acide peut être compris comme un composé chimique qui a la capacité en solution aqueuse H3 pour former des ions O ou pour convertir des ions OH en molécules d'eau. Une base, en revanche, a la capacité de former des ions OH ou H3 en solution aqueuse O à H2 O. |
De nombreuses substances appelées acides sont dès le départ des solutions aqueuses et ne peuvent pas être facilement comprises comme des composés chimiques qui ont des atomes d'hydrogène liés ioniquement. L'acide chlorhydrique est une solution aqueuse du chlorure d'hydrogène gazeux (HCl) et est considéré comme un acide fort. Dans cette solution - avant toute utilisation pratique de l'acide - l'équilibre (4) existe déjà, dans lequel l'équilibre est presque complètement du côté droit.
Le chlorure d'hydrogène a depuis longtemps épuisé son potentiel d'être un acide et H3 O ions formés. Les effets chimiques résultant de l'application pratique d'acide chlorhydrique sont dus aux réactions de H3 attribuée aux ions O. L'acide est le H3 O ion. La valeur du pH est la mesure de l'acidité (concentration) ici, tandis que dans le cas d'acides plus faibles, comme l'acide acétique, la mesure de la force de l'acide, la valeur pKa, est au premier plan. Les acides forts et faibles diffèrent dans leur tendance à "sembler" ou "moins comme" H3 pour former l'ion O dans l'eau. La section Équilibre acido-basique décrit ces tendances plus en détail.
| L'effet chimique dans l'utilisation pratique d'un acide est principalement sur H3 O ions de retour. On peut considérer les ions oxonium comme l'acide le plus important. |
Équilibre acido-basique
Lors de la protolyse, un réactif (généralement de l'eau) absorbe le proton dégagé par l'acide. Ceci doit être distingué des réactions redox dans lesquelles des transferts d'électrons ont lieu.
La réaction d'équilibre général d'un acide HA en solution aqueuse est :
Les acides diffèrent par leur tendance à transférer les ions H dans l'eau. C'est ce qu'on appelle la force de l'acide K s désigne et indique la constante d'équilibre (constante d'acide) de la réaction acide. La constante d'acidité est souvent donnée sous la forme de pK s -valeur, qui est définie comme le logarithme négatif de la constante d'acidité.
Acides avec un K majuscule s -valeur (petit pK s -valeur) sont des acides forts. Si le pH d'une solution contenant un acide est inférieur de deux unités au pK s valeur, seulement un centième du H3 O ions formés.
Acides polybasiques
Les acides qui peuvent séparer plusieurs protons sont appelés acides polyprotiques . Acide sulfurique (H2 SO4 ) est un acide phosphorique diprotique (également diprotique) (H3 Bon de commande4 ) un acide triprotonique (également triprotonique). La tentative de libération des protons individuels (protolyse) varie en taille et peut être calculée à l'aide de la constante d'acide (Ks ) décris. En général, ce qui suit s'applique aux étapes de protolyse individuelles :Ks (I)> Ks (II)> Ks (III) (ou pKs (Je)
Pour l'acide phosphorique :
pKS -Valeurs des acides importants
Réactions acido-basiques sans eau
De manière analogue aux réactions acido-basiques qui ont lieu dans des solutions aqueuses et avec la participation de l'eau, il existe des réactions dans d'autres milieux. Dans l'éthanol anhydre, une réaction a lieu avec le chlorure d'hydrogène, dans laquelle l'éthanol joue le rôle de base :
En phase gazeuse, les gaz ammoniac et chlorure d'hydrogène réagissent pour former le sel chlorure d'ammonium.
En plus de l'eau, d'autres solvants suffisamment polaires peuvent également agir comme réactifs dans les réactions acide-base. Un bon exemple est l'autoprotolyse de l'ammoniac liquide :
Exemples d'acides
Les acides importants sont :
- Acide sulfurique :H2 SO4 (usage industriel, pluies acides)
- Acide chlorhydrique :HCl (usage industriel)
- Acide phosphorique :H3 Bon de commande4 (Industrie alimentaire, y compris cola, matériel génétique)
- Acide carbonique :H2 CO3 (industrie alimentaire, technologie, ambiance)
- Acide acétique :CH3 COOH (industrie alimentaire)
- Acide fluorhydrique :HF (fabrication de puces informatiques)
- Acide nitrique :HNO3 (usage industriel)
Les sels d'acides polybasiques peuvent également agir comme des acides ("sels acides"), par exemple
- Bisulfates
- Hydrophosphates
Références
Développement historique des acides :
- Claus Priesner, Karin Figala :Alchimie :Encyclopédie d'une science hermétique. Beck, Munich 1998, ISBN 3406441068
- V. Karpenko, J.A. Norris :Le vitriol dans l'histoire de la chimie. Chem. Listy, Volume 96, 2002, pages :997-1005 [2]
- Donateurs en Bretagne
- Liste des acides
- bases
- Concepts acide-base