| formule structurelle | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| K | |||||||||
| Général | |||||||||
| Nom | Nitrite de potassium | ||||||||
| Autres noms | |||||||||
| Formule moléculaire | KNO2 | ||||||||
| Numéro CAS | 7758-09-0 | ||||||||
| Brève description | solide jaune blanchâtre | ||||||||
| Propriétés | |||||||||
| Masse molaire | 85,10 g mol | ||||||||
| État de la matière | corrigé | ||||||||
| Densité | 1.92g cm | ||||||||
| Point de fusion | 441 °C | ||||||||
| Point d'ébullition | Décomposition | ||||||||
| Solubilité | |||||||||
| Consignes de sécurité | |||||||||
| |||||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||||
Nitrite de potassium , KNO2 (aussi :Nitrate de potassium , anglais :nitrite de potassium ), est le sel de potassium de l'acide nitreux HNO2 .
Propriétés
Le nitrite de potassium forme des cristaux incolores à légèrement jaunâtres, hautement hygroscopiques (=attirant l'humidité) qui se dissolvent facilement dans l'eau lorsqu'ils sont refroidis, la solution réagit alcaline. Les cristaux se décomposent à partir de 360 °C. Sinon, il se comporte de la même manière que le nitrite de sodium, c'est-à-dire qu'il est oxydant (surtout à des températures élevées) et réagit violemment avec des métaux tels que l'aluminium (surtout sous forme de poudre !), les composés d'ammonium secs (tels que le sulfate d'ammonium), les cyanures et de nombreux composés organiques. C'est un agent réducteur qui se transforme lentement en nitrate de potassium KNO3 dans l'air oxydé.
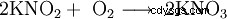
Le nitrite de potassium est toxique; en général, les nitrites peuvent réagir avec certaines amines dans des conditions appropriées pour former des nitrosamines cancérigènes. Le nitrite peut être détecté avec du sulfate ferreux et de l'acide sulfurique concentré en brunissant.
Occurrence et production
Dans la nature, les nitrites sont des étapes intermédiaires du cycle de l'azote - à la fois dans la nitrification (liaison de l'azote) et dans la dénitrification (libération de l'azote). Techniquement, le nitrite de potassium est obtenu par l'action des oxydes d'azote sur une solution d'hydroxyde de potassium.
Utilisation
Le nitrite de potassium peut être utilisé comme additif alimentaire sous le numéro E 249 (Conservateurs) peuvent être utilisés sous certaines conditions dans le sel de cure nitrite (chlorure de sodium avec nitrite de potassium et nitrite de sodium). Il donne à la viande une couleur rouge permanente par la formation de nitrosomyoglobine. Les produits de viande et de charcuterie peuvent contenir un multiple de la limite de nitrite dans l'eau potable.
Origine
- ↑ Entrée pour CAS no. 7758-09-0 dans la base de données des substances GESTIS du BGIA, récupéré le 14 décembre 2007 (JavaScript requis)



