| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| 2+ | |||||||
| Général | |||||||
| Nom | carbonate d'ammonium | ||||||
| Autres noms | |||||||
| Formule moléculaire | (NH4 )2 CO3 | ||||||
| Numéro CAS | 10361-29-2 | ||||||
| Brève description | solide incolore | ||||||
| Propriétés | |||||||
| Masse molaire | 96,09 g mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 1.6g cm | ||||||
| Point de fusion | se décompose à 58 °C | ||||||
| Point d'ébullition | se désintègre avant | ||||||
| Pression de vapeur | |||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Carbonate d'ammonium , (NH4 )2 CO3 H2 O forme des cristaux cubiques incolores solubles dans l'eau de poids moléculaire Mr du 114.10. Il se décompose complètement en ammoniac, dioxyde de carbone et eau à 58 °C.
Propriétés
Le sel forme une poudre incolore avec une légère odeur d'ammoniaque. Il a une densité d'environ 1,6 g cm (à 20 °C) et une solubilité élevée dans l'eau d'environ 220 g/L. La solution réagit faiblement alcaline, un équilibre entre l'ammoniac NH3 s'établit , ions ammonium NH4 , ions carbonate CO3 , ions hydrogénocarbonate HCO3 et dioxyde de carbone CO2 a.
Le sel réagit ainsi avec l'eau et l'acide carbonique pour former des ions hydrogénocarbonate et hydroxyde. Une solution aqueuse de carbonate d'ammonium n'est donc stable que dans un environnement neutre et faiblement basique - le gaz carbonique s'échappe dans les acides et le gaz ammoniac dans les alcalis concentrés.
Synthèse
Le carbonate d'ammonium peut être préparé en faisant réagir du dioxyde de carbone avec de l'ammoniac dans une solution aqueuse.
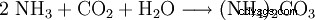
Une autre façon de l'afficher consiste à chauffer du carbonate de calcium avec du sulfate d'ammonium.

Avec cette dernière méthode, le bicarbonate d'ammonium et le carbamate d'ammonium se subliment en plus du carbonate d'ammonium souhaité, laissant le sulfate de calcium sous forme solide.
Utilisation
Le carbonate d'ammonium est utilisé dans la synthèse d'hétérocycles et comme additif dans les révélateurs photographiques. Il est également utilisé dans la teinture, comme générateur de dioxyde de carbone dans les extincteurs et comme sel odorant.
Il est également utilisé comme agent levant (également connu sous le nom de sel de corne de cerf). Dans l'UE, il porte le numéro E 503i en tant qu'additif alimentaire. approuvé.
Le carbonate d'ammonium est souvent utilisé en chimie inorganique pour une analyse qualitative afin de précipiter les cations de métaux alcalino-terreux de baryum, de strontium et de calcium d'un échantillon inconnu en tant que groupe, de les séparer et de les identifier à l'aide de réactions de détection.

