| Borax | |
| Cristaux de borax de Californie | |
| Chimie | Na2 [B4 O5 (OH)4 ] · 8H2 O |
| Classe minérale | Groupe des borates V/H.10-30 (d'après Strunz) 26.4.1.1 (d'après Dana) |
| Système de cristal | monoclinique |
| Classe Cristal | monoclinique-prismatique 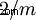 |
| Couleur | incolore, blanc, gris, jaune, vert |
| Couleur du trait | blanc |
| Dureté de Mohs | 2 à 2,5 |
| Densité (g/cc) | 1.72 |
| Briller | Vitré à mat |
| Transparence | transparent à opaque |
| Fraction | coquillage |
| Clivage | parfait |
| Habitus | cristaux prismatiques ou tabulaires courts, colonnaires, terreux, granuleux, agrégats massifs |
| Faces de cristal communes | |
| Jumelage | |
| Aspect cristal | |
| Indice de réfraction | α=1.447 β=1.469 à 1.470 γ=1.472 |
| Biréfringence (orientation optique) | Δ=0,025; 39° à 40°, biaxial négatif |
| pléochroïsme | incolore |
| Angle/dispersion des axes optiques | 2vz ~ |
| Propriétés supplémentaires | |
| Transitions de phases | |
| Point de fusion | 878 °C |
| Comportement chimique | soluble dans l'eau et la glycérine |
| Minéraux similaires | kernite, colémanite, sassoline, soda, trona |
| Radioactivité | non radioactif |
| Magnétisme | non magnétique |
| Signes distinctifs | |
Borax , également connu sous le nom de Tinkal , Borate de sodium ou par son nom chimique Tétraborate de disodium décahydraté connu, est un minéral borate plutôt rare de la classe minérale des borates du groupe. Il cristallise dans le système cristallin monoclinique avec la formule chimique Na2 [B4 O5 (OH)4 ] · 8H2 O ou Na2 B4 O7 · 10H2 O ou Na2 O x 2 B2 O3 · 10H2 O et développe surtout des cristaux courts, prismatiques ou tabulaires, mais aussi des agrégats terreux, granuleux ou massifs, le plus souvent de couleur blanche ou grise. Parfois, il est incolore.
Propriétés spéciales
Chauffé à environ 100 °C, il perd une partie de son eau de cristallisation et forme un pentahydrate. Au-dessus de 400 °C, on obtient du tétraborate de sodium anhydre qui fond à 878 °C. La masse molaire du tétraborate de sodium est de 201,22 g mol, celle du décahydrate est de 381,37 g mol. La masse volumique de la substance anhydre est de 2,37 g cm, celle du décahydrate est de 1,72 g cm.
Étymologie et Histoire
Le borax a été décrit pour la première fois en 1748 par le minéralogiste suédois Johan Gottschalk Wallerius. Le nom dérive du mot arabe bauraq pour "blanc". Il était déjà utilisé dans l'antiquité en Chine pour les émaux et en Egypte pour l'embaumement.
Formation et localités
Le borax se présente dans la nature sous forme cristalline ou solide semblable à l'anhydrite ou au gypse sous forme d'évaporite, c'est-à-dire qu'il est formé par l'assèchement des lacs salés, qui sont alors également appelés lacs de borax, et se présente donc sous forme de sédiments. On peut également le trouver dans les cheminées volcaniques.
Une occurrence naturelle se trouve à Boron, en Californie, où elle est exploitée à ciel ouvert. D'autres localités incluent Kırka en Turquie, ainsi que le lac Borax et le lac Searles/Californie aux États-Unis.
Aujourd'hui, le borax est obtenu presque exclusivement à partir du kernit minéral de borax, qui contient moins d'eau cristalline.
Utilisation
comme matière première
Le borax est une matière première importante pour la production d'acide borique, pour la production de borates et de perborates ainsi que d'autres composés de bore. Le borax est utilisé pour les glaçures sur la faïence, la céramique, la porcelaine, le verre et dans la production d'émail.
Son utilisation comme fondant dans le brasage des métaux précieux, ainsi que dans le forgeage et le forgeage repose sur son effet désoxydant (antioxydant).
Le borax est un ingrédient de base dans la fabrication du jouet Slime, avec de l'alcool polyvinylique, de l'eau distillée et du colorant alimentaire.
en chimie
De nombreux oxydes métalliques se dissolvent dans la masse fondue de borax, formant des couleurs caractéristiques et, après refroidissement, forment une perle semblable à du verre, la perle de borax. Ces colorants sont utilisés pour identifier les cations dans le processus de séparation des cations.
La couleur de flamme verte qui se produit lorsque le méthanol est brûlé avec du borax et est causée par le borate de triméthyle est un simple indicateur de méthanol.
De plus, le borax est utilisé dans les solutions tampons (tampon borate et borate-phosphate) et dans la solution borax-carmin (Solution de Grenachers ) utilisé comme colorant en microscopie.
dans le ménage
À la maison, le borax est utilisé dans les savons, les adoucisseurs d'eau et comme perborate dans les détergents. Le borax est utilisé dans les désinfectants, les agents de nettoyage et les agents de blanchiment, ainsi que dans les insecticides (pour les pièges à fourmis).
De plus, le borax agit comme agent préventif de protection du bois contre les moisissures et les insectes et est utilisé à environ 1 % de la quantité totale consommée comme retardateur de flamme, ici principalement pour les matériaux d'isolation à base de cellulose. Dans cette dernière application, ses propriétés sont considérées comme partiellement problématiques et une réduction est considérée comme raisonnable.
En tant qu'additif alimentaire, il porte la désignation E 285.
Précautions
[[Help:Cache|Erreur lors de la création de la vignette]] :Le borax peut provoquer une inflammation s'il entre en contact avec la peau ou les yeux, ou si la poudre fine est inhalée. L'ingestion peut provoquer une irritation du tractus gastro-intestinal; de plus grandes quantités sont mortelles (phrases R et S :R :36/37-62, S :22-26-36/37/39-45).
Le numéro CAS du tétraborate de sodium anhydre est le 1330-43-4, le pentahydraté 1332-28-1 et le borax (tétraborate de sodium décahydraté) 1303-96-4.
- Systématique des minéraux
- Liste des minéraux
Preuves individuelles
- ↑ Webmineral - Borax
- ↑ MinDat - Borax
- ↑ Entrée sur le tétraborate de sodium dans la base de données des substances GESTIS du BGIA, récupérée le 25 septembre 2007 (JavaScript requis)
- ↑ Martin Okrush, Siegfried Matthes :Minéralogie . 7e édition. Springer Verlag, Berlin 2005, ISBN 3-540-23812-3
- ↑ Encyclopédie de base compacte Römpp de chimie . Edité par Jürgen Falbe et Manfred Regitz. Edité par Eckard Amelingmeier et al Thieme, Stuttgart/New York 1998, ISBN 3-13-115711-9
- ↑ Pigments Kremer - Borax
- ↑ Université de Bayreuth – Expériences d'effet :Slime
- ↑ Leisewitz et al. Rapport de recherche n° 297 44 542 pour le compte de l'Agence fédérale de l'environnement (décembre 2000), p. 121 et suiv.
Références
- Edition Dörfler :Encyclopédie minérale , Nebel Verlag, ISBN 3-89555-076-0
