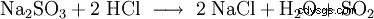| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Général | |||||||
| Nom | Dioxyde de soufre | ||||||
| Autres noms | |||||||
| Formule moléculaire | SO2 | ||||||
| Numéro CAS | 7446-09-5 | ||||||
| Brève description | gaz incolore, piquant et toxique | ||||||
| Propriétés | |||||||
| Masse molaire | 64,06 g mol | ||||||
| État de la matière | gazeux | ||||||
| Densité | 2,73 kg m (1 bar, 15°C) | ||||||
| Point de fusion | −75 °C | ||||||
| Point d'ébullition | −10 °C | ||||||
| Pression de vapeur | |||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| MAK | |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Dioxyde de soufre , SO2 , est l'anhydride de l'acide sulfureux H2 SO3 . Le dioxyde de soufre est un gaz incolore et toxique avec une odeur piquante et un goût amer. Il est principalement produit lors de la combustion de combustibles fossiles contenant du soufre, tels que le charbon ou les produits pétroliers, qui contiennent jusqu'à 4 % de soufre. En conséquence, il contribue de manière significative à la pollution de l'air, c'est la cause des pluies acides, où le dioxyde de soufre est d'abord oxydé par l'oxygène pour former du trioxyde de soufre, puis avec de l'eau pour former de l'acide sulfurique (H2 SO4 ) est mis en œuvre. Pour éviter cela, il existe différents procédés de désulfuration des fumées.
Fabrication
- en brûlant du soufre ou du sulfure d'hydrogène
- en grillant des minerais sulfurés
par exemple. B. de pyrite :
-

- Le disulfure de fer(II) et l'oxygène réagissent pour former de l'oxyde de fer(III) et du dioxyde de soufre.
- des sulfites par des acides plus forts
Propriétés
| Numéro E | 220 |
| température critique | 157,5 °C |
| pression critique | 7,9 bars |
Une formule limite mésomérique du dioxyde de soufre est la suivante :
En termes généraux :
Le dioxyde de soufre liquide dissout de nombreuses substances et s'est donc imposé comme un solvant précieux.
Utilisation
Le dioxyde de soufre se trouve dans l'industrie alimentaire sous le nom E 220 utilisé comme conservateur et antioxydant, notamment pour les fruits secs, les plats de pommes de terre, les jus de fruits, la confiture et le vin. Il est également utilisé pour produire du chlorure de sulfuryle SO2 Cl2 et chlorure de thionyle SOCl2 .
En outre, le dioxyde de soufre est une matière première importante pour la production de trioxyde de soufre, afin de produire ensuite de l'acide sulfurique concentré, par ex. B. avec la méthode de contact.
Le dioxyde de soufre est également utilisé dans la fabrication de nombreux produits chimiques, médicaments et colorants, ainsi que dans le blanchiment du papier et des textiles.
Pollution
À fortes concentrations, le SO2 est nocif pour les humains, les animaux et les plantes. Les produits d'oxydation se traduisent par des "pluies acides" qui mettent en danger les écosystèmes sensibles tels que les forêts et les lacs et attaquent les bâtiments et les matériaux.
Les émissions totales de SO2 ont été considérablement réduites dans les pays industrialisés développés au cours des deux dernières décennies grâce à l'utilisation de combustibles et de carburants à faible teneur en soufre ou sans soufre.
Consignes de sécurité
Une concentration de dioxyde de soufre supérieure à la valeur MAK peut provoquer des maux de tête, des nausées et de la somnolence chez l'homme. À des concentrations plus élevées, le gaz endommage gravement les bronches et les poumons ou même les acides nucléiques, porteurs de propriétés héréditaires.
Origine
- ↑ Fiche de données de sécurité (Praxair)
- ↑ Base de données des substances dangereuses BGIA Gestis
- ↑ Holleman-Wiberg :Manuel de chimie inorganique 102e édition, de Gruyter, Berlin, 2007.