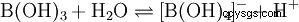| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| General | |||||||
| Nombre | ácido bórico | ||||||
| Otros nombres | Borofax | ||||||
| Fórmula molecular | H3 BO3 | ||||||
| Número CAS | 10043-35-3 | ||||||
| Breve descripción | polvo blanco | ||||||
| Propiedades | |||||||
| Masa molar | 61,83 g/mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 1,44 g/cm | ||||||
| Punto de fusión | Se descompone a 185°C | ||||||
| Punto de ebullición | no existe | ||||||
| Presión de vapor | 2,7 hPa (20 °C) | ||||||
| Solubilidad | 50 g/l en agua | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| MAC | ninguno | ||||||
| LD50 | 2660 mg/kg | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
ácido bórico (también:ácido ortobórico ), H3 BO3 , es el ácido de oxígeno más simple del boro, sus sales se llaman boratos. (Anteriormente también llamado hidróxido de boro)
Propiedades
El ácido bórico puro forma cristales escamosos, incoloros y brillantes que tienen un punto de fusión de 171 °C. Al principio es difícil de disolver en agua, pero este proceso se acelera con el aumento de la concentración. La solución reacciona débilmente ácida. Se forma un éster metílico de ácido bórico volátil con metanol, incluso sin ácido sulfúrico concentrado, que se quema con una llama verde y se utiliza para la detección cualitativa de boro.
Cuando se calienta el ácido ortobórico, el agua se separa y se forma el ácido metabórico HBO2, que se presenta en varias modificaciones. y finalmente, con mayor eliminación de agua, trióxido de diboro B2 O3 .
A pesar de sus tres átomos de hidrógeno, el ácido bórico reacciona como un ácido monoprótico en agua, produciendo el ion tetrahidroxoborato, B(OH)4 . Aquí no se comporta como un ácido de Brønsted como donante de protones, sino como un ácido de Lewis como aceptor de hidróxido:
El ácido bórico es un ácido muy débil (pKs =9,25). Por reacción con alcoholes polihídricos tales. B. manitol, la fuerza del ácido se puede aumentar significativamente. Esto se debe a un desplazamiento del equilibrio a la derecha hacia un derivado de tetraoxoborato como resultado de la esterificación:
Esta reacción se utiliza para la titulación alcalimétrica de ácido bórico y también se utiliza en la determinación de nitrógeno de Kjeldahl.No es tóxico en pequeñas cantidades. pero los boranos son muy tóxicos.
Ocurrencia y Extracción
El ácido bórico libre se encuentra en las fuentes de vapor (fumarolas) del centro de Italia en la Toscana. El ácido se puede obtener de estas fuentes evaporándolo en plaquetas brillantes. El ácido bórico también se encuentra en la Toscana como el mineral sassolin. Sin embargo, las sales alcalinas y alcalinotérreas, como el mineral kernita Na2, son de gran importancia B4 O7 · 4H2 O. Un mineral similar, más raro, es el bórax, que contiene 8 o 10 equivalentes de agua cristalina. Hoy en día, sin embargo, esto se obtiene principalmente de kernit. Al tratar el bórax con ácido clorhídrico o ácido sulfúrico, el ácido bórico B(OH)3 liberar.
Uso
La solución acuosa ("agua de perforación") sirve como desinfectante suave y también está aprobada como conservante E284. El ácido bórico es un intermediario utilizado en la fabricación de vidrio de borosilicato, porcelana, esmalte y también se encuentra en retardantes de llama y mordientes. La producción mundial anual de ácido bórico supera las 200 kilotoneladas.
Otra aplicación del ácido bórico es en centrales nucleares con reactores de agua a presión. Allí, el ácido bórico se utiliza debido al alto coeficiente de absorción de neutrones térmicos del isótopo B-10, que está presente en el boro natural al 20 por ciento, para controlar el factor de multiplicación k y, por tanto, la potencia del reactor.
Además, el ácido bórico se utiliza para calcular el CO2 -Salario utilizado en la tierra en la antigüedad. En un ambiente ácido, se incorpora más boro al ácido bórico. Cuando el pH cambia a alcalino, el ácido bórico se convierte en borato, la sal del ácido bórico. Dado que los foraminíferos (tanto fósiles como organismos unicelulares recientes) necesitan borato para construir su caparazón, la relación se puede usar para determinar qué pH estaba presente en esta área y en qué momento de la historia de la tierra. Dado que las conchas de tales protozoos, así como los mejillones, etc. constituyen la mayor parte del sedimento marino, los núcleos de sedimento pueden extraerse de allí y examinarse en el laboratorio en busca de los dos isótopos de boro. Dichos resultados se correlacionaron bien con las burbujas de aire atrapadas en los núcleos de hielo.
El ácido bórico combinado con metanol produce una llama de color verde; en conexión con otros alcanoles un borde de llama verde. Esta propiedad se usa mucho en espectáculos de fuego, por ejemplo, para colorear palos de fuego, pois o cuencos de fuego.
Fuentes
- ↑ Hoja de datos de seguridad de materiales (Merck)