| Estructura de estructura | |||||||
|---|---|---|---|---|---|---|---|
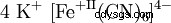 | |||||||
| Todas las gemas | |||||||
| Nombre | Kaliumhexacianidoferrato(II) | ||||||
| Otros Nombres |
| ||||||
| Resumen formal | C6 FeK4 N6 | ||||||
| Número CAS |
| ||||||
| Kurzbeschreibung | zitronengelbe Kristalle | ||||||
| Eigenschaften | |||||||
| Masa molar | 368,34 g·mol (wasserfrei) | ||||||
| Soporte agregado | fiesta | ||||||
| Dicho | 1,85 g/cm | ||||||
| Schmelzpunkt | bei ca. 70 °C Kristallwasserabgabe des Trihydrats | ||||||
| Siedepunkt | > 400 °C (Zersetzung) | ||||||
| Löslichkeit | gut löslich en Wasser:337 g/l (20 °C) | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| MAK | nicht festgelegt | ||||||
| WGK | 2 | ||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Hexacianidoferrato(II) de potasio ist ein Salz mit der Konstitutionsformel K4 [Fe(CN)6 ]. Es wird auch als Kaliumferrocyanid , Gelbes Blutlaugensalz oder Gelbkali bezeichnet. Man findet noch häufig die Bezeichnung Kaliumhexacyanoferrat(II) nach älterer Nomenklatur der IUPAC. Es ist en Wasser und Aceton gut, en Ethanol und Ether nicht löslich. Die wässerige Lösung zersetzt sich im Licht allmählich unter Bildung von Fe(OH)3 .
Herstellung
Hergestellt wird Kaliumhexacianidoferrat(II) aus einer Eisen(II)-Salzlösung und Kaliumcyanid. Es enthält dann Kristallwasser und liegt als K4 [Fe(CN)6 ]·3H2 O (Kaliumhexacianidoferrat(II)-Trihydrat) vor. Oberhalb von 60 °C gibt es das Kristallwasser wieder ab und geht in ein farbloses Pulver über, bei 100 °C ist es wasserfrei. Bei noch stärkerem Erhitzen zerfällt es unter Bildung von Kaliumcyanid (KCN), FeC2 y N2 .
Unter Normalbedingungen ist das Hexacianidoferrat(II)-Ion jedoch ein stabiler Komplex, es ist daher ungiftig.
Früher wurde Kaliumhexacyanidoferrat(II) durch Glühen von eingetrocknetem Blut, Hornspänen und anderen tierischen Substanzen mit Eisenspänen und Pottasche hergestellt, daher auch die Bezeichnung als Gelbes Blutlaugensalz.
Verwendung
In der Analytik wird das Salz zum Nachweis von Eisen(III)-Ionen verwendet. En Lösung erhält man bei Zugabe von Fe-Ionen zunächst lösliches Berliner Blau, K[FeFe(CN)6 ], durch einen Überschuss fällt unlösliches Berliner Blau aus, Fe[FeFe[(CN)6 ]3 . Diese Reaktionen dienen zum Nachweis von Eisen(III)-Ionen:
In der Lebensmittelindustrie wird Kaliumhexacianidoferrat als Trennmittel und Stabilisator verwendet. Es darf in Lebensmitteln jedoch nur in geringen Mengen verwendet werden, da sich beim Erhitzen oder bei Einwirkung von Säuren Blausäure bilden kann.Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E536 ausschließlich für die Verwendung in Kochsalz und Kochsalzersatz zugelassen.
Quellen
- ↑ Eintrag zu Kaliumhexacianidoferrat(II) in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 31.8.2007 (JavaScript erforderlich)
- Kaliumhexacianidoferrato (III) (rotes Blutlaugensalz)
- cianuro

