| estructura cristalina | |||||||
|---|---|---|---|---|---|---|---|
| No hay fórmula estructural disponible | |||||||
| General | |||||||
| Nombre | Óxido de Magnesio | ||||||
| Otros nombres | Magnesia | ||||||
| Fórmula de proporción | MgO | ||||||
| Número CAS | 1309-48-4 | ||||||
| Breve descripción | cristales incoloros | ||||||
| Propiedades | |||||||
| Masa molar | 40 g/mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 3,65 g·cm | ||||||
| Punto de fusión | ~2800 °C | ||||||
| Punto de ebullición | ~3600 °C | ||||||
| Solubilidad | prácticamente insoluble en agua | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Óxido de Magnesio (MgO ) o Magnesia es una sal que consta de iones Mg y O. Cristaliza en la red de cloruro de sodio. El óxido de magnesio se produce quemando magnesio, se puede obtener por precipitación del agua de mar o se puede producir calentando un compuesto de magnesio (por ejemplo, hidróxido de magnesio Mg(OH)2 ). o carbonato de magnesio MgCO3 ).
En este último caso, el comportamiento químico del óxido de magnesio depende mucho de la temperatura de producción y del proceso de producción. La llamada "magnesita quemada cáustica" se produce cuando el carbonato de magnesio natural (magnesita) se "quema" a unos 800 °C. El dióxido de carbono se escapa durante el proceso de cocción, pero la temperatura es demasiado baja para permitir la sinterización. Por lo tanto, los granos de óxido de magnesio resultantes todavía tienen la forma exterior de carbonato de magnesio, son porosos y muy reactivos debido a la gran superficie interior. Con agua, se forma hidróxido de magnesio en poco tiempo. La reacción de algunas sales de magnesio disueltas en agua con magnesita quemada cáustica conduce a la cristalización de una masa dura como una roca. Es la sal de magnesio cloruro de magnesio MgCl2 , se habla de cemento Sorel. Este se utiliza para la fabricación de pisos industriales. Además, la magnesita quemada con sosa cáustica se utiliza en la industria de fertilizantes y alimentos para animales como portador de magnesio. El óxido de magnesio también se usa para la terapia de sustitución.
A 1700 °C a 2000 °C se forma magnesia sinterizada, por encima de 2800 °C se forma magnesia fundida. Ambas variedades apenas reaccionan con el agua. La magnesia sinterizada se utiliza para revestimientos de hornos y equipos de laboratorio debido a su resistencia al fuego (punto de fusión 2800 °C). La magnesia se utiliza en la producción de refractarios básicos para la fabricación de cemento, la extracción de metales no ferrosos, refinadores de acero y vidrio, y la fabricación de ladrillos de magnesia-carbono, principal material utilizado en la fabricación de revestimientos refractarios para recipientes siderúrgicos (convertidores , horno de arco eléctrico y cuchara). Sin magnesia, estos materiales no se pueden fabricar con métodos modernos. Este material también se utilizó en el pasado para aislar tubos entre el filamento y el cátodo de los tubos de electrones debido a su resistencia al calor.
El óxido de magnesio se produce naturalmente como un mineral volcánico periclasa antes de. Son cristales regulares de color gris a verde oscuro, vítreos, con una dureza de 5,5 a 6.
Se añade a los alimentos como regulador de la acidez o antiaglomerante.Está clasificado como aditivo alimentario E 530 en la UE sin límite máximo (quantum satis ) generalmente aprobado para alimentos.
Fabricación
Hay varias formas de producir óxido de magnesio:
El vapor de etanol (cuando se calienta) reacciona con el magnesio para formar óxido de magnesio y etano:
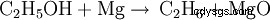
Cuando el magnesio se quema en el aire, reacciona con el oxígeno para formar óxido de magnesio:
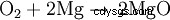
Pruebas individuales
- ↑ ChemDat de Merck, versión 2.13.2, 2005
