| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| General | |||||||
| Nombre | Urea | ||||||
| Otros nombres |
| ||||||
| Fórmula molecular | CH4 N2 O | ||||||
| Número CAS | 57-13-6 | ||||||
| Breve descripción | sólido cristalino incoloro con olor a amoníaco | ||||||
| Propiedades | |||||||
| Masa molar | 60,06 g mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 1,3230g·cm | ||||||
| Punto de fusión | 132,5-134,5 °C | ||||||
| Punto de ebullición | Descomposición a partir de 130 °C | ||||||
| Presión de vapor | 0,2 Pa (75 °C) | ||||||
| Solubilidad | fácilmente soluble en agua:aproximadamente 1000 g l (20 °C), soluble en etanol:50 g l (20 °C), ligeramente soluble en éter y cloroformo | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| WGK | 1 | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Urea (del latín urea), también conocida como diamida del ácido carbónico, que no debe confundirse con el ácido úrico, es un compuesto orgánico producido por muchos animales como producto final del metabolismo de los compuestos nitrogenados (p. ej., aminoácidos) en el llamado ciclo de la urea y se excreta en la orina. La urea pura es un sólido blanco, cristalino, no tóxico e higiénico con un ligero olor a amoníaco.
Historia
La urea fue el primer compuesto orgánico producido sintéticamente. Fue descubierto como sustancia por Hilaire Rouelle en 1773 y sintetizado artificialmente por primera vez por Friedrich Wöhler en 1828 al hacer reaccionar cianato de potasio y sulfato de amonio. Esto contradecía la noción que estaba muy extendida en ese momento, de que las sustancias orgánicas básicamente solo se pueden encontrar en los seres vivos a través de la llamada "vis vitalis". (fuerza vital) podría crearse y allanar el camino para la química orgánica.
Importancia fisiológica
La urea proviene del metabolismo de proteínas y aminoácidos y pertenece a las sustancias urinarias Para evitar la formación de amoníaco (NH3 ) de los grupos amino, estos se transfieren a la molécula de urea no tóxica en el hígado en el transcurso del ciclo de la urea. Esta se excreta como producto metabólico final a través de los riñones.
Enfermedades como la insuficiencia renal aguda o crónica y la insuficiencia renal diabética pueden provocar un aumento de los valores de urea en el suero/plasma.
Trastornos y peculiaridades: Una ingesta elevada de proteínas conduce a un aumento de los valores de urea incluso con una función renal normal, lo que la convierte en un parámetro renal deficiente.
Aplicaciones
Debido a su alto contenido de nitrógeno del 46%, la urea es el fertilizante nitrogenado más importante a nivel mundial. Debido a su alta capacidad de retención de agua, la urea también se usa con frecuencia como factor humectante en cosméticos. En farmacia, la urea se conoce como queratolítico. Esta propiedad se utiliza en varias recetas. Por ejemplo, está muy concentrado (40 %) en pastas junto con un antifúngico (agente antifúngico) contra los hongos en las uñas (onicomicosis), por lo que la urea suaviza la uña para que la sustancia de la uña infectada pueda eliminarse pieza por pieza. También se utiliza como hidratante en ungüentos para combatir eccemas atópicos y enfermedades liquenicas.
Los fabricantes de cigarrillos añaden urea al tabaco para que la nicotina se absorba mejor aumentando el valor del pH. De esta forma, los cigarrillos supuestamente light con un valor bajo de nicotina en el paquete se convierten en cigarrillos fuertes.
La urea también se puede utilizar como sustituto de la sal para carreteras; sin embargo, por razones de costo, esto no es rentable.
En la tecnología de motores diesel, la urea se inyecta detrás de un filtro de hollín en el flujo de escape caliente para reducir los óxidos de nitrógeno en los gases de escape. El consumo es del 2 al 8% en relación al combustible.
Se añade a los alimentos como estabilizador. En la UE está catalogado como aditivo alimentario con la designación E 927b Aprobado exclusivamente para chicles sin azúcar añadido.
Propiedades
Cuando se funde, la urea se descompone con la liberación de amoníaco (NH3 ) a Biuret:
Fabricación industrial
La urea se produce industrialmente en grandes cantidades (2004:127 millones de toneladas en todo el mundo) y se utiliza, p. B. como fertilizante nitrogenado o como NOx -Agente reductor en el proceso SNCR. En países con grandes reservas de gas natural, que antes simplemente se quemaban, el gas natural ahora se convierte en urea. Para ello se utilizan grandes plantas, que finalmente producen urea a partir de gas natural, aire y agua en las etapas del proceso producción de hidrógeno → producción de amoníaco → síntesis de urea. El CO2 ligado como urea y no liberado a la atmósfera. La urea, que inicialmente está en solución, se convierte en gránulos y se vende en sacos oa granel. Las plantas más grandes del mundo producen alrededor de 4000 toneladas de urea por día.
Ecuaciones de reacción:
-
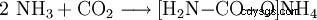
- El amoníaco y el dióxido de carbono reaccionan para formar carbamato de amonio.
-
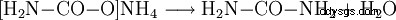
- El carbamato de amonio reacciona para formar urea y agua.
Otro uso industrial de la urea es la producción de melamina, que se utiliza p. B. se procesa con formaldehído para formar resinas sintéticas y resinas de urea-formaldehído (resina de urea, las llamadas resinas UF), la z. B. utilizado para la producción de aglomerado.
Fuentes
- ↑ Base de datos de sustancias de BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 23 de julio de 2007
- AdBlue
- Nitrato de urea
- tiourea
