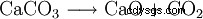| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| No hay fórmula estructural disponible | |||||||
| General | |||||||
| Nombre | Óxido de calcio | ||||||
| Otros nombres |
| ||||||
| Fórmula molecular | CaO | ||||||
| Número CAS | 1305-78-8 | ||||||
| Breve descripción | polvo blanco | ||||||
| Propiedades | |||||||
| Masa molar | 56,08 g mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 3,37 g·cm (20 °C)> | ||||||
| Punto de fusión | 2570-2580 °C | ||||||
| Punto de ebullición | 2850 °C (100 mbar) | ||||||
| Presión de vapor | no aplicable | ||||||
| Solubilidad | apenas en agua, 1,65 g l (a 20 °C), reacción violenta | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| MAC | levantado | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Óxido de calcio (también cal quemada , cal viva , cal viva o lima ) es un polvo blanco que reacciona con el agua con el desprendimiento de calor. La reacción produce hidróxido de calcio (cal apagada ) formado:
La cal viva es de quemado suave y endurecido distinguido.
Fabricación
- Artículo principal: Ciclo técnico de cal
A escala industrial, el óxido de calcio se produce mediante la combustión de cal. Por encima de una temperatura de alrededor de 800 °C, la piedra caliza (carbonato de calcio) se desacidifica, es decir, se expulsa dióxido de carbono y se forma óxido de calcio.
Se hace una distinción entre la cal quemada, entre otras cosas, según la velocidad a la que la cal reacciona con el agua (el llamado proceso de apagado):
<2 min tiempo de reacción:cal blanda
2 - 6 min tiempo de reacción:cal viva
> 6 min tiempo de reacción:cal viva
Sin embargo, no existen definiciones precisas.
Las diferencias en la velocidad de reacción son consecuencia del tamaño de los cristalitos del CaO, el volumen de poro y el área de superficie específica, que están influenciados por la temperatura y la duración de la cocción.
Cal blanda quemada producido a temperaturas de 900-1000 °C, cal dura a hasta 1400 °C, por lo que la duración del efecto de la temperatura también suele desempeñar un papel.
Cuando cantidades más pequeñas (escala de laboratorio) son suficientes, se puede obtener oxidando el calcio.
El óxido de calcio reactivo se obtiene por descomposición térmica del hidróxido de calcio, que se descompone a 550 °C bajo presión atmosférica en óxido de calcio y agua. El óxido de calcio formado en estas condiciones no es muy cristalino, por lo que es muy reactivo.
La cal viva (quickfast) y la cal apagada (hidróxido de calcio) son altamente corrosivas (pH 12-13), ¡el contacto con los ojos puede causar ceguera!
Uso
La cal viva se utiliza en la industria de la construcción como aditivo para morteros y también es un componente menor del clínker de cemento. En química, la sustancia también se utiliza como agente secante. Otras áreas de aplicación de la cal quemada son, p. B. cal fertilizante, la producción de carburo de calcio y para la producción de mortero de cal, yeso de cal y pintura de cal y para su uso como agente neutralizante.
Una de las principales áreas de aplicación es la desulfuración de arrabio, donde el azufre [S] se presenta como un compañero [FeS] y debe disolverse en el camino hacia el acero (convertidor). La cal (CaO) se sopla en el arrabio o con un agitador mezclado. La cal se combina con el azufre para formar sulfuro de calcio [CaS] y sube a la superficie donde se deposita como escoria. Esto se elimina con una máquina raspadora después de la desulfuración.
El óxido de calcio tiene una aplicación importante como precursor en la producción de hidróxido de calcio mediante la adición de agua (cal apagada o cal apagada ).
La cal apagada se utiliza, entre otras cosas, como alternativa a la piedra caliza en la desulfuración de gases de combustión. La cantidad utilizada aquí es aproximadamente 1,8 veces menor que para la piedra caliza. El yeso (sulfato de calcio) obtenido de la cal viva tiene un grado de blancura del 80% y puede utilizarse comercialmente. Debido a su alta reactividad, se requieren menores cantidades de consumo. La desventaja es su precio significativamente más alto en comparación con la piedra caliza.
La cal de cloro se puede producir a partir de hidróxido de calcio mediante otras reacciones.
Se añade a los alimentos como regulador de la acidez. Se utiliza principalmente como un llamado adyuvante técnico que ya no está presente en el alimento terminado. En la UE se clasifica como un aditivo alimentario con la designación E 529 sin límite máximo (quantum satis ) generalmente aprobado para alimentos.
Fuentes
- ↑ Entrada sobre óxido de calcio en la base de datos de sustancias GESTIS de la BGIA, recuperada el 4 de octubre de 2007 (se requiere JavaScript)
- ↑ Hoja de datos de seguridad de materiales (Merck)