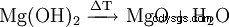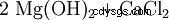| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| No hay fórmula estructural disponible | |||||||
| General | |||||||
| Nombre | Hidróxido de Magnesio | ||||||
| Otros nombres | Hidróxido de magnesio (II), brucita, E528 | ||||||
| Fórmula molecular | Mg(OH)2 | ||||||
| Número CAS | 1309-42-8 | ||||||
| Breve descripción | polvo blanco | ||||||
| Propiedades | |||||||
| Masa molar | 58,33 g mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 2,38 g·cm | ||||||
| Punto de fusión | Descomposición a 350 °C | ||||||
| Solubilidad | no en agua y alcohol, bueno en soluciones de sal de amonio y ácidos diluidos (L=1 10 mol l; en agua a 25°C) | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| MAC | no establecido | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Hidróxido de magnesio Mg(OH)2 es un polvo blanco amorfo. Ocasionalmente ocurre en la naturaleza como el mineral brucita. La red cristalina de brucita consiste en una esfera hexagonal más cercana empaquetada de iones de hidróxido. Cada segunda capa de espacio octaédrico está ocupada por iones de magnesio (Mg).
Propiedades
El hidróxido de magnesio es escasamente soluble en agua y soluciones alcalinas, pero fácilmente soluble en soluciones ácidas (por ejemplo, ácido clorhídrico, ácido nítrico). El hidróxido de magnesio también es fácilmente soluble en soluciones de sal de amonio, ya que los iones de hidróxido son interceptados por los iones de amonio:
-
 .
.
El hidróxido de magnesio forma sales básicas y neutras con ácidos.
A temperaturas superiores a 350 °C, se produce lentamente la descomposición en óxido de magnesio. A 600 °C el equilibrio está prácticamente del lado de los óxidos.
Obtención y visualización
El hidróxido de magnesio se puede obtener del licor residual de la extracción de potasa por precipitación con lechada de cal (1) o del agua de mar por precipitación con dolomita quemada (2). A continuación, el producto se filtra y se seca a unos 100 °C. El hidróxido de magnesio particularmente puro es creado por la acción del agua sobre el magnesio elemental (3).
(1) 
(2) 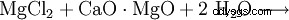
(3) 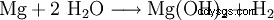
Uso
La mayor parte del hidróxido de magnesio producido con fines industriales se procesa posteriormente en óxido de magnesio mediante calcinación (cocción) a 500–600 °C.
El hidróxido de magnesio se utiliza como aditivo de aceite comestible (para unir dióxido de azufre), como floculante para el tratamiento de aguas residuales, como retardante de llama en termoplásticos (poliolefinas, PVC) y elastómeros, y como aditivo en detergentes.
En medicina se usa como antiácido (medicamento para neutralizar el ácido estomacal) y como laxante muy fuerte.
El hidróxido de magnesio se añade a los alimentos como regulador de la acidez o agente antiadherente. Está aprobado en la UE como aditivo alimentario con el número E E 528.
Fuentes
- ↑ Base de datos de sustancias peligrosas de BGIA Gestis