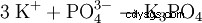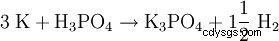| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| 3K | |||||||
| General | |||||||
| Nombre | Fosfato de potasio | ||||||
| Otros nombres | fosfato tripotásico | ||||||
| Fórmula molecular | K3 PO4 | ||||||
| Número CAS | 7778-53-2 | ||||||
| Propiedades | |||||||
| Masa molar | 212,28 g mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 2,56 kg·m | ||||||
| Punto de fusión | 1340 °C | ||||||
| Solubilidad | soluble en agua | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Fosfato de potasio es la sal potásica del ácido fosfórico.
Obtención/Representación
El fosfato de potasio también se forma cuando la escoria Thomas se calienta con carbón y sulfato de potasio.
Propiedades
El fosfato de potasio se disuelve en agua con una reacción alcalina.
Fabricación:
Uso
Los fosfatos se utilizan como aditivos en los detergentes y pueden reducir la dureza del agua formando complejos con iones metálicos multivalentes (Mg, etc.). Su uso ahora está prohibido en algunos países (incluida Suiza).
Los fosfatos también se utilizan como fertilizantes artificiales.
Importancia biológica
La consecuencia de su uso en detergentes es un mayor aporte de nutrientes en los cuerpos de agua. Esto da como resultado un mayor crecimiento de algas, lo que puede provocar que una masa de agua se vuelque.
El fosfato de potasio se conoce en homeopatía como agente nervioso.