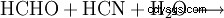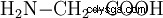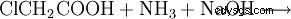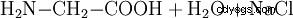| strukturformel | ||
|---|---|---|
| Allmänt | ||
| namn | Glycin | |
| Förkortning | Gly, G | |
| Restname | glycyl | |
| väsentligt | nej | |
| Andra namn | Glykol, glykol, aminoättiksyra | |
| Molekylformel | C2 H5 NEJ2 | |
| CAS-nummer | 56-40-6 | |
| Kort beskrivning | vit solid | |
| Egenskaper | ||
| Molar massa | 75,07 g/mol | |
| Sakens tillstånd | fixat | |
| Densitet | 1,595 g/cm | |
| Smältpunkt | 450-500°F | |
| Kokpunkt | > 230 °C termisk sönderdelning | |
| Ångtryck | Pa (°C) | |
| sidokedja | ingen sidokedja, annars hydrofil | |
| Löslighet | bra i vatten (225 g/l vid 20 °C), dålig på alkohol, olöslig i opolära lösningsmedel | |
| isoelektrisk punkt | 6.06 | |
| pK-värden vid 25 °C | pKCOOH :2,4 pKNH2 :9,8 | |
| van der Waals volym | 48 | |
| Hydrofobicitetsbetyg | −0.4 | |
| Säkerhetsinstruktioner | ||
| ||
| R- och S-fraser | R:inga riskfraser S:inga S-fraser | |
| MAK | inte angivet | |
| Där det är möjligt och vanligt, används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | ||
Glycin (kemiskt kallad aminoättiksyra), är den minsta och enklaste proteinogena aminosyran. Den tillhör gruppen hydrofila aminosyror och är den enda proteinogena aminosyran som inte är kiral och därför inte optiskt aktiv.
Glycin är inte nödvändigt, så det kan produceras av den mänskliga organismen själv och är en viktig komponent i nästan alla proteiner och en viktig nod i ämnesomsättningen.
Namnet kommer från den söta smaken av rent glycin (gr. glycis :Söt).
Syntes
Glycin bildas bland annat i reaktionen av formaldehyd, vätecyanid och vatten:
Denna reaktion är av särskild betydelse på grund av hypotesen att utgångsmaterialen kunde ha bildats från den så kallade uratmosfären som omgav jorden för cirka 4 miljarder år sedan. Hon hade en förmodligen gjord av väte (H2 ), helium (He) och i mindre utsträckning metan (CH4 ), ammoniak (NH3 ) och några andra ädelgaser.
Kemiskt kan glycin också framställas av monoklorättiksyra och ammoniak:
I kroppen får man mest glycin från mat, men det kan också göras av serin.
Funktioner
Metabolism
Förutom att producera glycin, tjänar omvandlingen av serin till glycin även till att omvandla tetrahydrofolsyra till N-N-metylen-tetrahydrofolsyra, vilket krävs bland annat för syntesen av tyminnukleotider (DNA-komponent).
Glycin krävs också direkt för syntesen av andra komponenter i det genetiska materialet (puriner). Det tjänar också biosyntesen av hem (syrebindning i blodet), kreatin (energilagring i musklerna) eller glutation.
Som en så kallad glukogen aminosyra kan glycin omvandlas till glukos via pyruvat som en del av ämnesomsättningen.
Giftig oxalsyra kan också bildas från glycin som en biprodukt.
Det är särskilt vanligt i kollagen, det vanligaste proteinet i djurorganismer. Här står den för en dryg tredjedel av alla aminosyror, eftersom dess ringa storlek gör att kollagenet kan hamna i sin trippelhelixstruktur.
nervsystemet
Glycin verkar i det centrala nervsystemet via glycinreceptorn som en hämmande signalsubstans, det vill säga som en hämmande signalsubstans. Det verkar genom att öppna ligand-styrda kloridkanaler, vilket leder till en hämmande postsynaptisk potential (IPSP), som minskar nedströms neuronaktivitet.
Glycinfrisättande nervceller (glycinerga neuroner) finns främst i ryggmärgen och hämmar de så kallade motoneuronerna i det främre hornet, vilket resulterar i en minskning av muskelaktiviteten hos de muskler som innerveras av cellerna.
Strychnin, en antagonist av glycinreceptorn, och stelkrampstoxin, som hämmar frisättningen av glycin, orsakar en minskning av effekten av glycin. Förlusten av hämning ökar muskelaktiviteten. Detta kan leda till livshotande kramper.
Användning
Glycin tillsätts i livsmedel som en smakförstärkare.
Glycin och dess natriumsalt är numrerade E 640 som en livsmedelstillsats i EU Generellt godkänd för livsmedel utan begränsningar i maxkvantitet, hälsoeffekter är inte kända.
Referenser
- G. Löffler, P. E. Petrides:Biochemistry and Pathobiochemistry , 7:e upplagan, Springer Verlag, 2003, ISBN 3-540-42295-1