| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| 2 Na | |||||||
| Allmänt | |||||||
| Namn | Natriumsulfat | ||||||
| Andra namn | dinatriumsulfat, E 514, glaubersalt (Na2 SO4 · 10H2 O) | ||||||
| Molekylformel | Na2 SO4 | ||||||
| CAS-nummer | 7757-82-6 | ||||||
| Kort beskrivning | färglösa och luktfria kristaller | ||||||
| Egenskaper | |||||||
| Molarmassa | 142,04 g mol | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 2,70 g cm | ||||||
| Smältpunkt | 884 °C | ||||||
| Kokpunkt | 1689 °C | ||||||
| Löslighet | bra i vatten:170 g/l, vid 20 °C | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Natriumsulfat (Na2 SO4 , föråldrat namn Natriumsulfat ) är ett natriumsalt av svavelsyra och består av två Na-katjoner (Na) och sulfatanjonen (SO4 ) tillsammans.Dekahydratet (Na2 SO4 · 10H2 O) kallas även Glaubersalz efter kemisten Johann Rudolph Glauber Kallas även Carlsbad Salt , som erhålls genom att indunsta Karlovy Vary mineralvatten, består huvudsakligen av natriumsulfatdekahydrat och används som laxermedel, som Glaubers salt.
Historik
Natriumsulfat framställdes och beskrevs omkring 1655 av kemisten och apotekaren Johann Rudolph Glauber. Han själv kallade saltet han upptäckte Sal mirabilis och Mirabili .
Erhålla och visa
Natriumsulfat utvinns sällan från naturliga mineraler, eftersom det ofta är en biprodukt av kemiska industrireaktioner där svavelsyra neutraliseras med kaustiksoda. En annan möjlighet för teknisk representation är reaktionen av bergsalt (NaCl) med svavelsyra för att erhålla saltsyra med natriumsulfat som biprodukt (vid 800°C):
-
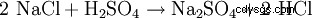
- Natriumklorid och svavelsyra reagerar och bildar natriumsulfat och väteklorid.
Natriumsulfat kan framställas i laboratoriet genom följande reaktioner:
-

- Natrium och svavelsyra reagerar och bildar natriumsulfat och väte.
-
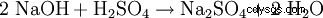
- Natriumsulfat och vatten produceras vid neutralisering av kaustiksoda med svavelsyra.
Egenskaper
Det vattenfria natriumsulfatet smälter vid 884 °C, är hygroskopiskt och lättlösligt i vatten vid upphettning (lösningsvärme). Däremot löses dekahydratet upp under stark kylning, på grund av den så kallade entropieffekten. Natriumsulfatdekahydrat är en komponent i många mineralvatten och smälter långsamt i sitt eget kristallvatten från cirka 32 °C. Det vattenfria saltet separeras från denna lösning, som är övermättad med vattenfritt natriumsulfat.
Användning
Natriumsulfat används i tvättmedel som fyllmedel, i medicin som laxermedel, i massatillverkning (sulfatprocess) och i glas-, textil- och färgindustrin. Glödgat, vattenfritt natriumsulfat används i laboratoriet för att torka organiska lösningsmedel. Natriumsulfatdekahydrat (Glaubers salt ) används som ett laxermedel och latent värmelagringsmaterial.
Inom livsmedelsteknik används det som uppstramningsmedel, surhetsreglerande medel och bärarsubstans. Natriumsulfat och natriumvätesulfat är livsmedelstillsatser numrerade E 514 i EU utan maxgräns (quantum satis ) allmänt godkänd för livsmedel.
Källor
- ↑ https://www.zusatzstoffe-online.de/zusatzstoffe/216.e514_natriumsulfate.html
