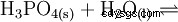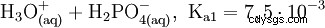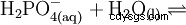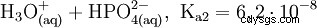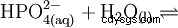| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Allmänt | |||||||
| Namn | fosforsyra | ||||||
| Andra namn | orto-fosforsyra | ||||||
| Molekylformel | H3 PO4 | ||||||
| CAS-nummer | 7664-38-2 | ||||||
| Kort beskrivning | färglöst och luktfritt fast material | ||||||
| Egenskaper | |||||||
| Molarmassa | 98,00 g mol | ||||||
| Sakens tillstånd | fast (ofta flytande, eftersom en underkyld smälta kan lagras under lång tid) | ||||||
| Densitet | 1,834 g cm (18°C) | ||||||
| Smältpunkt | 42,35°C | ||||||
| Kokpunkt | Nedbrytning:213 °C (dehydrering) | ||||||
| Ångtryck | 3,8 Pa (20 °C) | ||||||
| pKa-värde | 2,16; 7,21; 12.32 | ||||||
| Löslighet | helt blandbar med vatten, lättlöslig i alkohol | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| MAK | 2 mg m (respirabel aerosolfraktion) | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Det normala eller orto- Fosforsyra är huvudsyran i fosfor. Det vattenfria ämnet är mycket hygroskopiskt. Det är en triprotisk syra och reagerar som en måttligt stark syra med avseende på den första deprotoneringen. Kondensaten difosforsyra, meta- och polyfosforsyror härrör från det. Som livsmedelstillsats är fosforsyra listad som E 338 deklarerade.
Erhålla och visa
Fosforsyra kan erhållas från bergfosfat (mest apatit, Ca5 (PO4 )3 (F, OH, Cl)) med svavelsyra, saltsyra eller salpetersyra. CaSO4 bildas som biprodukter (anhydrit, gips) och H2 [SiF6 ] (hexafluorkiselsyra). Alternativt kan fosforsyra erhållas genom att bränna elementärt fosfor för att bilda fosforpentoxid, P4 O10 och efterföljande hydrolys (så kallad termisk fosforsyra).
Egenskaper
Fosforsyra är en tribasisk syra som kan donera sitt väte som solvatiserade protoner i tre steg för att bilda divätefosfat, vätefosfat och fosfatanjoner. De associerade pKs-värdena är pKs1 =2,161; pKs2 =7,207 och pKs3 =12,325.
Användning
Fosforsyra används som råvara för framställning av fosfathaltiga gödselmedel (>90 % av produktionen i USA), rengöringsmedel, rostborttagare eller rostkonverterare och för passivering av järn och zink för att skydda mot korrosion. Zinkfosfatcement används inom tandvården.
Även om det har en frätande effekt i höga koncentrationer, används det utspätt i livsmedelsindustrin som konserveringsmedel, surgörande medel (särskilt i coladrycker) och som surhetsreglerande medel (E 338), eftersom fosforsyra är ogiftigt för den mänskliga organismen , förutom dess frätande effekt. Den är också lämplig för att bereda buffertlösningar (olika "fosfatbuffertar").
Biologisk betydelse
Fosforsyraestrar spelar en central roll i ämnesomsättningen, särskilt som energi- och gruppbärare (se t.ex. ATP och GTP). De är en integrerad del av DNA, RNA, många koenzymer, etc.
Bevis
Fosforsyran och lösliga fosfater kan separeras genom utfällning med ammoniummolybdat för att bilda gult ammoniummolybdatfosfat, eller genom utfällning med magnesiumjoner i en ammoniaklösning för att bilda MgNH4 PO4 bevisa.
Källor
- ↑ RÖMPP Online, Thieme 2007
- ↑ BGIA GESTIS ämnesdatabas:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 3 mars 2007
- ↑ ESIS-European Chemical Substances Information System
- andra syreföreningar av fosfor