| Borax | |
| Boraxkristaller från Kalifornien | |
| Kemi | Na2 [B4 O5 (OH)4 ] · 8H2 O |
| Mineralklass | Gruppborater V/H.10-30 (efter Strunz) 26.4.1.1 (efter Dana) |
| Crystal System | monoklinisk |
| Crystal Class | monoklinisk-prismatisk 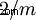 |
| Färg | färglös, vit, grå, gul, grön |
| Linjefärg | vit |
| Mohs hårdhet | 2 till 2,5 |
| Densitet (g/cc) | 1,72 |
| Skin | Glasaktig till matt |
| Öppenhet | transparent till ogenomskinlig |
| Bråk | shelly |
| Klyvning | perfekt |
| Habitus | korta prismatiska eller tabellformade kristaller, kolumnformade, jordnära, granulära, massiva aggregat |
| Vanliga kristallansikten | |
| Twinning | |
| Kristallutseende | |
| Refraktionsindex | α=1,447 β=1,469 till 1,470 γ=1,472 |
| Dubbelbrytning (optisk orientering) | A=0,025; 39° till 40°, biaxiell negativ |
| pleokroism | färglös |
| Vinkel/spridning för de optiska axlarna | 2vz ~ |
| Ytterligare egenskaper | |
| Fasövergångar | |
| Smältpunkt | 878 °C |
| Kemiskt beteende | lösligt i vatten och glycerin |
| Liknande mineraler | kernite, colemanite, sassoline, soda, trona |
| Radioaktivitet | icke-radioaktiva |
| Magnetism | icke-magnetisk |
| Särskiljande märken | |
Borax , även känd som Tinkal , Natriumborat eller med dess kemiska namn Dinatriumtetraboratdekahydrat känd, är ett ganska sällan förekommande boratmineral från mineralklassen av gruppborater. Det kristalliseras i det monokliniska kristallsystemet med den kemiska formeln Na2 [B4 O5 (OH)4 ] · 8H2 O eller Na2 B4 O7 · 10H2 O eller Na2 O x 2 B2 O3 · 10H2 O och utvecklar mestadels korta, prismatiska eller skivformade kristaller, men också jordnära, granulära eller massiva aggregat, mestadels vita eller grå till färgen. Ibland är den färglös.
Särskilda egenskaper
När den värms upp till cirka 100 °C förlorar den en del av sitt kristallvatten och bildar ett pentahydrat. Över 400 °C erhålls vattenfritt natriumtetraborat, som smälter vid 878 °C. Den molära massan av natriumtetraborat är 201,22 g mol, den för dekahydratet är 381,37 g mol. Densiteten för det vattenfria ämnet är 2,37 g cm, den för dekahydratet är 1,72 g cm.
Etymologi och historia
Borax beskrevs första gången 1748 av den svenske mineralogen Johan Gottschalk Wallerius. Namnet kommer från det arabiska ordet bauraq för "vit". Den användes redan i antiken i Kina för glasyrer och i Egypten för balsamering.
Formation och orter
Borax förekommer i naturen i kristallin eller fast form liknande anhydrit eller gips som evaporit, d.v.s. den bildas genom uttorkning av saltsjöar, som då också kallas boraxsjöar, och förekommer därför som sediment. Det kan också hittas i vulkaniska öppningar.
En naturlig företeelse är i Boron, Kalifornien där det bryts i dagbrott. Andra platser inkluderar Kırka i Turkiet, samt Borax Lake och Searles Lake/Kalifornien i USA.
Idag utvinns borax nästan uteslutande från boraxmineralkärnan, som har mindre kristallvatten.
Användning
som råvara
Borax är en viktig råvara för framställning av borsyra, för framställning av borater och perborater samt andra borföreningar. Borax används till glasyrer på lergods, keramik, porslin, glas och vid framställning av emalj.
Dess användning som flussmedel vid lödning av ädelmetaller, såväl som vid smidessvetsning och smide är baserad på dess oxidavlägsnande effekt (antioxidant).
Borax är en grundläggande ingrediens i tillverkningen av Slime-leksaken, tillsammans med polyvinylalkohol, destillerat vatten och matfärg.
i kemi
Många metalloxider löser sig i smältan av borax, bildar karakteristiska färger och bildar efter kylning en glasliknande pärla, boraxpärlan. Dessa fläckar används för att identifiera katjoner i katjonseparationsprocessen.
Den gröna lågans färg som uppstår när metanol förbränns med borax och orsakas av trimetylborat är en enkel indikator på metanol.
Dessutom används borax för buffertlösningar (borat- och borat-fosfatbuffertar) och i borax-karminlösningen (Grenachers-lösning ) används som färgämne i mikroskopi.
i hushållet
I hemmet används borax i tvål, i vattenavhärdare och som perborat i rengöringsmedel. Borax används i desinfektionsmedel, rengöringsmedel och blekmedel samt i insekticider (för myrfällor).
Vidare fungerar borax som ett förebyggande träskyddsmedel mot mögel och insekter och används till cirka en procent av den totala mängden som förbrukas som flamskyddsmedel, här främst för cellulosabaserade isoleringsmaterial. I den senare applikationen ses dess egenskaper som delvis problematiska och en minskning anses vara förnuftig.
Som livsmedelstillsats har den beteckningen E 285.
Försiktighetsåtgärder
[[Hjälp:Cache|Fel vid skapande av miniatyrbild]]:Borax kan orsaka inflammation om det kommer i kontakt med hud eller ögon, eller om det fina pulvret andas in. Förtäring kan orsaka irritation i mag-tarmkanalen; större mängder är dödliga (R- och S-fraser:R:36/37-62, S:22-26-36/37/39-45).
CAS-numret för vattenfritt natriumtetraborat är 1330-43-4, pentahydrat 1332-28-1 och borax (natriumtetraboratdekahydrat) 1303-96-4.
- Systematik för mineraler
- Lista över mineraler
Individuella bevis
- ↑ Webmineral - Borax
- ↑ MinDat - Borax
- ↑ Post om natriumtetraborat i GESTIS ämnesdatabasen för BGIA, hämtad den 25 september 2007 (JavaScript krävs)
- ↑ Martin Okrush, Siegfried Matthes:Mineralogi . 7:e upplagan. Springer Verlag, Berlin 2005, ISBN 3-540-23812-3
- ↑ Römpp kompakta grundläggande uppslagsverk för kemi . Redaktör Jürgen Falbe och Manfred Regitz. Redigerad av Eckard Amelingmeier et al. Thieme, Stuttgart/New York 1998, ISBN 3-13-115711-9
- ↑ Kremer Pigments - Borax
- ↑ University of Bayreuth – Effektexperiment:Slim
- ↑ Leisewitz et al. Forskningsrapport nr 297 44 542 på uppdrag av Federal Environment Agency (december 2000), s. 121 ff.
Referenser
- Edition Dörfler:Mineral Encyclopedia , Nebel Verlag, ISBN 3-89555-076-0
