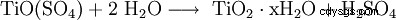| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Ingen strukturformel tillgänglig | |||||||
| Allmänt | |||||||
| Namn | Titan(IV)oxid | ||||||
| Andra namn |
| ||||||
| Molekylformel | O2 Ti | ||||||
| CAS-nummer | 13463-67-7 | ||||||
| Kort beskrivning | vitt kristallint pulver | ||||||
| Egenskaper | |||||||
| Molarmassa | 79,90 g mol | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 4,24 g cm | ||||||
| Smältpunkt | 1855°C | ||||||
| Kokpunkt | 2900°C | ||||||
| Löslighet | dålig i fluorvätesyra, koncentrerad salpetersyra och svavelsyra, olöslig i vatten, saltsyra, utspädd salpetersyra och svavelsyra | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| Termodynamiska egenskaper | |||||||
| ΔHf | −249 kJ/mol (rutil) | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Titan(IV)oxid (Titandioxid ) är en av titanoxiderna.
Förekomster
Titan(IV)oxid förekommer naturligt i tre modifikationer:
- Rutil är ett tetragonalt mineral med mestadels prismatisk vana. Namnet rutile kommer från latinets rutilus – rödaktig. Rutil har en densitet på 4,26 g/cm. Det är särskilt populärt som ett vitt pigment.
- Anatas bildar tetragonala holoedriska kristaller (holoedrisk betyder den mest symmetriska gruppen inom ett kristallsystem, i det tetragonala alltså 4/m 2/m 2/m). Anatas omvandlas gradvis (snabbare från en temperatur på över 700 °C) irreversibelt till rutil. Densiteten av anatas är 3,88 g/cm. Anatas fungerar också som ett vitt pigment.
- Brookite bildar ortorombiska mineraler och fungerar inte som ett vitt pigment. Brookite förvandlas också till rutil under smältpunkten.
Eftersom de naturliga avlagringarna har störande färger som z. B. genom järn i ilmenit (FeTiO3 ) orsakas, raffineras dessa i sulfatprocessen eller kloridprocessen (föredraget).
Erhålla och visa
Genom solvolys (hydrolys) av Ti(IV)-föreningen:
Egenskaper
Smältpunkten för titandioxid är 1855 °C. Den är termiskt stabil, hållbar, har ett högt brytningsindex (2,8) och därför stor färg- och döljningsförmåga. Titandioxid är kemiskt mycket inert. Det är ljusäkta, billigt, helt giftfritt och därför det viktigaste vita pigmentet.
Användning
Titandioxid används som ett vitt färgämne. Den upptäcktes i Norge och USA 1908 och tillverkades där från 1909 under namnet Kronos Titanium White. Produktionen startade i Tyskland 1924 under namnet Degea-Titanweiß. Titanvit tillverkades endast i anatasform fram till 1938, men då främst i rutilform, som visade sig vara mer stabil mot oljebindemedel och organiska färgämnen. Den kallades därför också för rutilvit.
Titanvit har den högsta opaciteten av alla vita pigment och en utmärkt ljusningskapacitet. Den är kemiskt stabil, giftfri och finns under beteckningen E 171 som livsmedelstillsats i exempelvis tandkräm och hostdroppar. Det används också ibland i oljemålning. Inom det tekniska området används det i färger och lacker (t.ex. för väggfärg och textilier), i papper och som UV-blockerare i solkrämer och vitmedel i läkemedel (tabletter). Den fotokatalytiska effekten av TiO2 Nanopartiklar används i samband med UV-aktiviteten för "självrengörande" ytor (fotokatalytisk självrengöring). Färgämnet solcell (Grätzel cell) är återigen baserad på halvledaregenskaperna hos titandioxid. Titandioxid används också som huvudkomponenten i det keramiska dielektrikumet i klass 1 keramiska kondensatorer.
Titandioxid i anatasmodifieringen är huvudkomponenten i de katalysatorer som används för industriell denitrifiering av rökgaser med hjälp av SCR-processen.
Framställning av titanoxid med hjälp av sulfatprocessen ger utspädd syra (utspädd svavelsyra), varav en del återanvänds för framställning av titanoxid genom koncentrering. I vissa länder släpps en del av denna utspädda syra fortfarande ut i floder och hav eller dumpas.Kloridprocessen å andra sidan ger ingen utspädd syra. Det klor som används förblir till stor del i processcykeln.
TiO2 används även inom kakelbehandling, vilket gör att ytorna på de behandlade plattorna blir smutsavvisande.
Bevis
Titandioxid nyfälld i kyla är amfoter och löslig i utspädda mineralsyror. Rötningen sker med kaliumvätesulfat i en porslinsdegel. Det löses sedan i kallt vatten med lite svavelsyra. Med några droppar väteperoxid, den gula (grundläggande) till gul-orange (sur, foto) [Ti(O2 ) aq] katjon. Saltsyra och zink (granulat) bildar nybliven väte, som omvandlar Ti(IV) till rödviolett [Ti(H2 O)6 ] minskat.
Nanoteknik
Individuella bevis
- ↑ Post om titan(IV)oxid i BGIA:s ämnesdatabas GESTIS, hämtad den 29 november 2007 (JavaScript krävs)
- ↑ Susanne Donner:Städning med ljusets kraft . Technology Review, nr 7, juli 2006, s. 19ff.