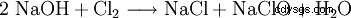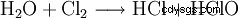| wzór strukturalny | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| Ogólne | ||||||||
| Nazwa | Podchloryn sodu | |||||||
| Inne nazwy | podchloryn sodu, podchloryn sodu, podchloryn sodu, L'eau de Labarraque/Eau de Javel (roztwór wodny) | |||||||
| Formuła molekularna | NaOCl | |||||||
| Numer CAS | 7681-52-9 | |||||||
| Krótki opis | żółte ciało stałe o nieprzyjemnym, słodkim zapachu | |||||||
| Właściwości | ||||||||
| Masa molowa | 74,44 g mol | |||||||
| Stan materii | naprawiono | |||||||
| Gęstość | 1,2 g cm (13% roztwór wolnego chloru) | |||||||
| Temperatura topnienia | 24,5°C (pięciowodzian) | |||||||
| Ciśnienie pary | 23 hPa (20 °C) | |||||||
| Rozpuszczalność | dobra w wodzie (293 g/l przy 0 °C, 942 g/l przy 23 °C, każdy pentahydrat) | |||||||
| Instrukcje bezpieczeństwa | ||||||||
| ||||||||
| WGK | 2 – niebezpieczny dla wody | |||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | ||||||||
Podchloryn sodu (NaOCl) to sól sodowa kwasu podchlorawego (znanego również jako podchlorawy) (HClO) Jest to biały proszek, który zwykle zawiera sześć moli wody krystalizacyjnej na mol podchlorynu sodu. Nazwa zwyczajowa wodnego roztworu podchlorynu sodu to Eau de Labarraque lub Woda Javel , gdzie etykieta Woda Javel jest całkowicie niepoprawne. Odnosi się to do roztworu podchlorynu potasu, ewentualnie w mieszaninie z innymi solami, takimi jak chlorek potasu; jednak często nie jest rozróżniany.
Uzyskiwanie/reprezentacja
Podchloryn sodu jest wytwarzany przez wprowadzenie gazowego chloru do sody kaustycznej lub przez elektrolizę roztworu chlorku sodu.
Ta reakcja powoduje poważne problemy techniczne. Ponieważ formalnie jest to hydroliza chloru zgodnie z
z późniejszą neutralizacją powstałego kwasu solnego lub kwasu podchlorawego łatwo zauważyć, że entalpie reakcji tych reakcji prowadzą do silnego ogrzewania, na które wszystkie podchloryny są wrażliwe. W rzeczywistości ten sam proces chemiczny jest używany do wytwarzania chloranu, ale poddając go reakcji w gorącym roztworze. Z tego powodu wszystkie techniczne podchloryny zawierają różne, czasem duże ilości chloranu. Reakcja podchlorynu wytwarzanego podczas produkcji z chlorem ostatecznie prowadzi do powstania chloranu.
Wykorzystanie
Celem stosowania jest wybielanie lub dezynfekcja (np. w basenach). Stosowanie w basenach nie jest bezproblemowe, ponieważ dozowane ilości muszą być wystarczające do chlorowania obecnego amoniaku (lub amin) powyżej poziomu monochloraminy, ponieważ tylko wtedy gwarantowana jest odpowiednia dezynfekcja.
Podchloryn sodu jest również głównym składnikiem aktywnym w dezynfekcji i wybielaniu domowych środków czyszczących, takich jak DanKlorix i wielu innych. Różne środki do usuwania pleśni również zawierają ten aktywny składnik.
Podchloryn sodu jest również stosowany w stomatologii. Na przykład jest stosowany w leczeniu kanałowym zębów zakażonych bakteryjnie w celu ich dezynfekcji.
Instrukcje bezpieczeństwa
Podczas obchodzenia się z podchlorynem sodu wymagana jest szczególna ostrożność! Istnieje ryzyko wybuchu, gdy podchloryn sodu reaguje z wieloma substancjami i grupami substancji, w tym z reduktorami, aminami, kwasem mrówkowym, metanolem, substancjami organicznymi i kilkoma innymi. Silnie atakuje błony śluzowe podczas wdychania.
Ponadto podchloryn sodu reaguje z kwasami (np. kwasem solnym, kwasem azotowym) i środkami utleniającymi (np. nadtlenkiem wodoru, nadmanganianem) czasami bardzo gwałtownie, wytwarzając ciepło i uwalniając gazowy chlor i/lub gazy azotowe.
Samo ciepło lub światło słoneczne może spowodować rozkład podchlorynu sodu, uwalniając między innymi chlor, chlorowodór, dwutlenek chloru i tlen. Należy to również wziąć pod uwagę podczas przechowywania substancji.
Źródła
- ↑ Baza danych substancji BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 12 maja. 2007