| wzór strukturalny | ||||||||
|---|---|---|---|---|---|---|---|---|
| Brak dostępnej formuły strukturalnej | ||||||||
| Ogólne | ||||||||
| Nazwa | wodorotlenek amonu | |||||||
| Inne nazwy | Roztwór amoniaku, woda, ług, amoniak żrący, amoniak żrący, roztwór amoniaku, spirytus staghorn, amoniak żrący, hydrat amonu | |||||||
| Formuła molekularna | NH4 Och | |||||||
| Numer CAS | 1336-21-6 | |||||||
| Krótki opis | bezbarwna, gryząca ciecz | |||||||
| Właściwości | ||||||||
| Masa molowa | 35,1 g mol | |||||||
| Stan materii | ciecz | |||||||
| Gęstość | 0,91 g/cm (25%) 0,88 g/cm (32%) | |||||||
| Temperatura topnienia | -57,5 °C (25%) -91,5 °C (32%) | |||||||
| Temperatura wrzenia | 37,7 °C (25%) 24,7 °C (32%) | |||||||
| Ciśnienie pary |
483 hPa (25%) | |||||||
| Rozpuszczalność | całkowicie mieszalny z wodą | |||||||
| Instrukcje bezpieczeństwa | ||||||||
| ||||||||
| MAK | 20 ml m; 14 mg/m | |||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | ||||||||
Wodorotlenek amonu , także roztwór amoniaku lub woda amoniakalna , w języku laboratoryjnym również tylko z. B. 25% amoniak nazywany jest przede wszystkim fizycznym roztworem amoniaku (NH3 ) w wodzie (H2 O), w którym częściowa protoliza zachodzi z wody do amoniaku, a zatem jest zasadowa. Nazwa wodorotlenek amonu sugeruje, że jest to substancja dająca się izolować, ale nie jest to możliwe. Dlatego to oznaczenie nie jest w rzeczywistości całkowicie poprawne, ale nadal jest używane, ponieważ charakteryzuje zachowanie substancji.W najwyższym stężeniu woda amoniakalna ma gęstość 0,880 g/cm3 (=32% ≙ 620 l NH3 w 1L H2 O).
Etykieta dodatku do żywności to E 527.
Geneza
Jeśli amoniak (NH3 ) w wodzie (H2 O) jest rozpuszczony, cząsteczki amoniaku (które są wbudowane w wodę polimerowego układu wiązań wodorowych i dlatego są fizycznie rozpuszczane) przechwytują poszczególne protony wytwarzane przez autoprotolizę wody:
-
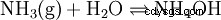 .
.
Większość nowo utworzonych cząsteczek reaguje z powrotem, więc większość rozpuszczonego amoniaku pozostaje w postaci NH3 , a nie jako NH4 istnieje.
Właściwości
Roztwory wodorotlenku amonu na ogół zawierają znaczną część amoniaku, który fizycznie rozpuszczony, tj. zmieszany z wodą, odparowuje w taki sam sposób jak woda, ze względu na wyższą prężność pary również znacznie szybciej, dlatego stężenie amoniaku w otwartych naczyniach zmniejsza się z czasem. Występuje typowy, ostry, przypominający lukrecję zapach amoniaku. B. analogiczne ze stęż. kwas solny odparowuje, tworząc gęsty biały dym chlorku amonu w niewodnej reakcji kwasowo-zasadowej.
W eksperymentach w niskich temperaturach związek addycyjny (NH3 H2 O) można wyizolować, który topi się w temperaturze -77°C. Jednak nie jest to rzeczywisty wodorotlenek amonu, ale raczej kryształy amoniaku z dołączoną wodą.
Instrukcje bezpieczeństwa
Dane na etykiecie w tabeli odnoszą się do stężonego roztworu (=32%), UE określiła następujące klasyfikacje dla innych zakresów stężeń:
| C ≥ 25% | C,N | R:34-50 |
| 10% ≤ C <25% | C | R:34 |
| 5% ≤ C <10% | Xi | R:36/37/38 |
Historia
Mówi się, że salmiak był znany starożytnym Egipcjanom i po raz pierwszy postulował go Arrhenius ze względu na jego sukces w opisaniu baz.
Wykorzystanie
Ciekły amoniak jest używany jako środek domowy do czyszczenia powierzchni w gospodarstwie domowym, ale jest również uważany za poufną wskazówkę do odstraszania os. W tym celu w zamkniętych pomieszczeniach do miski wsypuje się niewielką ilość płynu amoniakalnego, osy będą od tej pory unikały pomieszczenia ze względu na zapach. Na zewnątrz budynku weź ręczniki papierowe nasączone amoniakiem i rozłóż je w pobliżu gniazda os.
Zaleca się również stosowanie go do czyszczenia i zwalczania łagodnego lub umiarkowanego wzrostu pleśni na ścianach.
Innym obszarem zastosowania jest zwalczanie szkodników, takich jak rybiki cukrowe.
Niebezpieczeństwa
Roztwory wodorotlenku amonu zawierające więcej niż 10% amoniaku są żrące. Długotrwałe wdychanie może spowodować impotencję, m.in. B. w dymie tytoniowym z papierosów.
Połknięcie wody amoniakalnej powoduje silny ból, nieżyt żołądka, krwawe wymioty, uszkodzenie płuc i głosu, które często prowadzą do zgonu. Atakuje również oczy.
Ponieważ amoniak jest głównym produktem parowania, zagrożenia związane z tą substancją dotyczą również oparów amoniaku.


