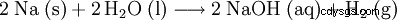| wzór strukturalny | |||||||
|---|---|---|---|---|---|---|---|
| Ogólne | |||||||
| Nazwa | Wodorotlenek sodu | ||||||
| Inne nazwy | Soda kaustyczna, soda kaustyczna, soda kaustyczna, steatyt, wodorotlenek sodu, wodorotlenek sodu, soda kaustyczna (roztwór wodny), E 524 | ||||||
| Formuła molekularna | NaOH | ||||||
| Numer CAS | 1310-73-2 | ||||||
| Krótki opis | białe, krystaliczne ciało stałe, często w postaci granulek | ||||||
| Właściwości | |||||||
| Masa molowa | 39,997 g mol | ||||||
| Stan materii | naprawiono | ||||||
| Gęstość | 2130 g/cm | ||||||
| Temperatura topnienia | 322°C | ||||||
| Temperatura wrzenia | 1388 °C | ||||||
| Ciśnienie pary | 13 Pa (618 °C) | ||||||
| Rozpuszczalność |
Łatwo rozpuszczalny w wodzie: | ||||||
| Instrukcje bezpieczeństwa | |||||||
| |||||||
| MAK | nie określono | ||||||
| WGK | 1 – lekko niebezpieczny dla wody | ||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | |||||||
Wodorotlenek sodu (również soda kaustyczna , soda kaustyczna ), wzór chemiczny NaOH , jest białym higroskopijnym ciałem stałym. Rozpuszcza się w wodzie z wytworzeniem dużej ilości ciepła dając silnie alkaliczną sodę kaustyczną (pH ok. 14 przy c =1 mol/l). Reaguje z dwutlenkiem węgla znajdującym się w powietrzu, tworząc węglan sodu i dlatego jest przechowywany w hermetycznych pojemnikach. Aby wodorotlenek sodu nie wiązał wody z powietrza, można go przechowywać razem ze środkiem osuszającym. Jako mocna zasada wypiera słabsze i bardziej lotne zasady z ich soli.
Światowa produkcja w 2001 roku wyniosła 46 milionów ton.
Produkcja
- Reakcja węglanu sodu z wodorotlenkiem wapnia z wytworzeniem wodorotlenku sodu i węglanu wapnia:
Słabo rozpuszczalny węglan wapnia jest odfiltrowywany. W przesączu pozostaje łatwo rozpuszczalny wodorotlenek sodu.
- Elektroliza chlorku sodu do sody kaustycznej, wodoru i gazowego chloru (elektroliza chloroalkaliów).
Istnieje kilka procesów przemysłowych:
- Procedura amalgamatu
- Procedura membranowa
- proces membranowy
(patrz także elektroliza chloro-alkaliczna)
Wspólne dla wszystkich procesów są dodatkowe etapy oczyszczania i zagęszczania w celu uzyskania bezwodnego wodorotlenku sodu.
- Wodorotlenek sodu można otrzymać w laboratorium w reakcji elementarnego sodu z wodą z wytworzeniem sody kaustycznej i wodoru:
- Po odparowaniu sody kaustycznej pozostaje stały wodorotlenek sodu:
Wykorzystanie
- Produkcja różnych mydeł (sody kaustycznej)
- Produkcja barwników (soda kaustyczna)
- Produkcja celulozy z drewna i słomy
- Merceryzacja bawełny
- Czyszczenie smaru, oleju i ropy naftowej
- Fermentacja boksytu (prekursor w produkcji aluminium)
- Synteza różnych chemikaliów (np. podchlorynu sodu, fosforanu sodu, siarczku sodu, glinianu sodu)
- Synteza kwasu mrówkowego
- Produkcja wody zdemineralizowanej:regeneracja wymieniaczy jonowych
- Rozwój odsłoniętego materiału płytek drukowanych w elektronice (ok. 10g/lw 20°C)
- Część środków do czyszczenia kanalizacji
- Robienie precli na brązowy kolor i „mydlany” smak
- Regeneracja dejonizatorów na potrzeby laboratorium i akwarium
- Trawienie płyt z mosiądzu, niklu, srebra i miedzi dla modelarza
- Oznaczanie kwasowości wina przy użyciu niebieskiego ługu
- Czyszczenie zbiorników ze stali nierdzewnej
- Usuwanie starej farby (zdzieranie)
- Do prostowania kręconych włosów (relaks)
- Lokomotywa Natron
- Wykrywanie wszystkich organicznych związków azotu („wykrywanie manuta”)
- Usuwanie skórek z owoców i warzyw (!) podczas przetwarzania przemysłowego
- hartowanie rozpuszczone w wodzie do hartowania stali
Przykład eksperymentalny
Jeśli dodasz trochę wodorotlenku sodu do wody, a następnie zamieszasz, roztwór się nagrzeje. Jest to odpowiedni jako prosty przykład egzotermicznego procesu rozwiązywania, który jest używany na przykład w szkole. Odwrotny efekt, endotermiczny proces rozpuszczania, można zaobserwować podczas rozpuszczania azotanu potasu lub saletry amonowej w wodzie, przy czym efekt jest znacznie silniejszy podczas rozpuszczania saletry amonowej (spadek temperatury o około 10 K).
Źródła
- ↑ Baza danych substancji BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 15 lutego 2007
- Sód