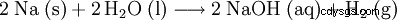| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| Generale | |||||||
| Nome | Idrossido di sodio | ||||||
| Altri nomi | Soda caustica, soda caustica, soda caustica, pietra ollare, idrossido di sodio, idrossido di sodio, soda caustica (soluzione acquosa), E 524 | ||||||
| Formula molecolare | NaOH | ||||||
| Numero CAS | 1310-73-2 | ||||||
| Breve descrizione | solido cristallino bianco, spesso sotto forma di pellet | ||||||
| Proprietà | |||||||
| Massa molare | 39,997 g mol | ||||||
| Stato della materia | risolto | ||||||
| Densità | 2.130 g cm | ||||||
| Punto di fusione | 322°C | ||||||
| Punto di ebollizione | 1388°C | ||||||
| Pressione di vapore | 13 Pa (618 °C) | ||||||
| Solubilità |
Facilmente solubile in acqua: | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| MAC | non impostato | ||||||
| WGK | 1 – leggermente pericoloso per l'acqua | ||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
Idrossido di sodio (anche soda caustica , soda caustica ), formula chimica NaOH , è un solido igroscopico bianco. Si dissolve in acqua con la generazione di grandi quantità di calore per dare soda caustica fortemente alcalina (pH circa 14 a c =1 mol/l). Reagisce con l'anidride carbonica nell'aria per formare carbonato di sodio e viene quindi conservato in contenitori ermetici. Per evitare che l'idrossido di sodio leghi l'acqua dall'aria, può essere conservato insieme a un essiccante. Essendo una base forte, rimuove le basi più deboli e volatili dai loro sali.
La produzione mondiale nel 2001 è stata di 46 milioni di tonnellate.
Produzione
- Reazione del carbonato di sodio con idrossido di calcio per formare idrossido di sodio e carbonato di calcio:
Il carbonato di calcio leggermente solubile viene filtrato. L'idrossido di sodio facilmente solubile rimane nel filtrato.
- Elettrolisi del cloruro di sodio in soda caustica, idrogeno e cloro gassoso (elettrolisi del cloruro).
Esistono diversi processi industriali:
- Procedura di amalgama
- Procedura diaframma
- processo della membrana
(vedi anche elettrolisi cloro-alcali)
Comuni a tutti i processi sono ulteriori fasi di purificazione e concentrazione per arrivare all'idrossido di sodio anidro.
- L'idrossido di sodio può essere ottenuto in laboratorio facendo reagire il sodio elementare con l'acqua per formare soda caustica e idrogeno:
- Dopo che la soda caustica è evaporata, rimane idrossido di sodio solido:
Utilizzo
- Produzione di saponi vari (soda caustica)
- Produzione di coloranti (soda caustica)
- Produzione di cellulosa da legno e paglia
- Cotone mercerizzato
- Pulizia di grasso, olio e petrolio
- Digestione della bauxite (precursore nella produzione di alluminio)
- Sintesi di varie sostanze chimiche (es. ipoclorito di sodio, fosfato di sodio, solfuro di sodio, alluminato di sodio)
- Sintesi di acido formico
- Produzione di acqua demineralizzata:rigenerazione degli scambiatori ionici
- Sviluppo di materiale per circuiti stampati a vista in elettronica (circa 10 g/l a 20°C)
- Parte dei pulitori di scarico
- Pretzel per la colorazione marrone e il gusto "saponato"
- Rigenerazione di deionizzatori per esigenze di laboratorio e acquario
- Acquaforte in ottone, alpacca e lastre di rame per il modellista
- Determinazione dell'acidità del vino mediante liscivia blu
- Pulizia serbatoi in acciaio inox
- Rimozione della vecchia vernice (sverniciatura)
- Per lisciare i capelli crespi (rilassante)
- Locomotiva Natron
- Rilevamento di tutti i composti organici dell'azoto ("Rilevamento del manute")
- Rimozione delle bucce da frutta e verdura (!) durante la lavorazione industriale
- Quincant disciolto in acqua per la tempra dell'acciaio
Esempio sperimentale
Se aggiungi un po' di idrossido di sodio all'acqua e poi lo mescoli, la soluzione si scalderà. Questo è adatto come semplice esempio di un processo di soluzione esotermica utilizzato, ad esempio, a scuola. L'effetto opposto, un processo di dissoluzione endotermica, può essere osservato quando si dissolve il nitrato di potassio o il nitrato di ammonio in acqua, con l'effetto molto più forte quando si dissolve il nitrato di ammonio (diminuzione della temperatura di circa 10 K).
Fonti
- ↑ Database delle sostanze BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 15 febbraio 2007
- Sodio