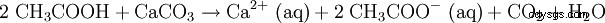| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Général | |||||||
| Nom | Acide acétique | ||||||
| Autres noms |
| ||||||
| Formule moléculaire | C2 H4 O2 | ||||||
| Numéro CAS | 64-19-7 | ||||||
| Brève description | liquide incolore à odeur piquante | ||||||
| Propriétés | |||||||
| Masse molaire | 60,05 g mol | ||||||
| État de la matière | liquide | ||||||
| Densité | 1.05g cm | ||||||
| Point de fusion | 17 °C | ||||||
| Point d'ébullition | 118 °C | ||||||
| Pression de vapeur | |||||||
| valeur pKa | |||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| MAK | |||||||
| Propriétés thermodynamiques | |||||||
| ΔHf | |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Acide acétique , selon la réglementation IUPAC acide éthanoïque , est un acide carboxylique caustique liquide incolore avec une odeur typique de vinaigre. En tant qu'additif alimentaire, il porte la désignation E260. Les solutions aqueuses d'acide acétique sont trivialement appelées vinaigre et acide acétique concentré acide acétique glacial. Le nom latin de l'acide acétique est Acidum aceticum . Les sels de l'acide acétique sont appelés acétates désigné. En biochimie, le terme acétate est préféré à celui d'acide acétique, car l'acide acétique se déprotone largement dans des conditions physiologiques sous forme d'anion acétate (CH3 COO) est présent.
Obtenir et afficher
Production biologique classique
La production classique d'acide acétique est la fermentation. Les bactéries Acetobacter convertissent l'éthanol (alcool) produit par d'autres processus de fermentation en acide acétique (vinaigre de fermentation). Les produits de départ peuvent par ex. g. vin, bière ou malt.Vinaigre ménager se compose de vinaigre de fermentation ou de vinaigre synthétique dilué et contient 5 % d'acide acétique. Essence de vinaigre est une solution d'acide acétique synthétique à 25 % dans l'eau, a une forte odeur piquante et ne peut être utilisée que diluée dans les aliments.
Fabrication de produits chimiques à grande échelle
La synthèse industrielle la plus importante de l'acide acétique est la conversion catalytique du méthanol avec du monoxyde de carbone sous pression (procédé Monsanto).
CH3OH + CO → CH3COOH
En dehors de cela, l'acide acétique peut également être synthétisé par oxydation de l'acétaldéhyde avec de l'air ou de l'oxygène à l'aide de Mn(OAc)2 comme catalyseur ou par oxydation partielle d'autres hydrocarbures.
Techniquement, l'oxydation à l'air du n-butane à environ 180 °C et 85 bar et l'oxydation catalytique de l'essence légère sont également utilisées.
Propriétés
Propriétés physiques
Lorsque l'acide acétique est dissous dans l'eau, environ chaque centième molécule d'acide acétique se dissocie pour former un ion acétate. Le proton séparé est transféré à une molécule d'eau. Les ions oxonium formés dans ce processus provoquent les propriétés acides des solutions d'acide acétique.
A 118 °C, l'acide acétique a un point d'ébullition relativement élevé par rapport aux substances polaires de masse molaire comparable (par exemple le 1-propanol :point d'ébullition 97 °C). La raison en est la capacité des molécules d'acide acétique à former deux liaisons hydrogène "mutuelles" via leurs groupes carboxyle, de sorte que des dimères sont formés à partir de deux molécules d'acide acétique, qui se comportent comme une molécule de deux fois la masse molaire. Par conséquent, une plus grande quantité d'énergie est nécessaire pour le transfert de ces dimères dans la phase gazeuse, reconnaissable à la température d'ébullition « augmentée ».
Propriétés chimiques
L'acide acétique s'oxyde complètement dans l'air pour former de l'eau et du dioxyde de carbone.
Les métaux de base tels que le magnésium, le calcium, le zinc ou le fer se dissolvent dans l'acide acétique dilué pour former des acétates solubles dans l'eau et libérer de l'hydrogène.
L'acide acétique réagit avec le cuivre en présence d'oxygène (air) pour former de l'acétate de cuivre, un sel vert nocif mieux connu sous le nom de vert-de-gris.
L'acide acétique réagit avec l'éthanol pour former de l'acétate d'éthyle, un solvant largement utilisé. En remplaçant l'éthanol par du 1-pentanol, on obtient de l'acétate d'amyle, qui est un ester à forte odeur. L'acide salicylique peut également être estérifié avec de l'acide acétique. Cela produit de l'acide acétylsalicylique, l'ingrédient actif de l'aspirine.
L'acide acétique réagit à 800 °C avec déshydratation en anhydride acétique.
L'acide acétique dilué est également utilisé pour dissoudre le calcaire (voir vinaigre). L'équation de réaction ressemble à ceci :
Propriétés thermodynamiques
L'entropie standard du liquide à un bar (Sl, 1 bar ) est de 158,0 J mol K, celle du solide (Ss ) 282,84 J mol K.
Utilisation
L'acide acétique est d'une grande importance en tant qu'agent aromatisant. L'acide acétique et ses sels l'acétate de potassium (E 261), l'acétate de sodium (E 262) et l'acétate de calcium (E 263) sont utilisés comme acidulants pour les fruits et légumes en boîtes et bocaux (acide acétique 0,5 à 3 %), pour toutes sortes de poissons, conserves, marinades diverses, salades de charcuterie, mayonnaise, vinaigrettes avec de l'acide sorbique (E 200) ou de l'acide benzoïque (E 210) et pour mariner et laver la viande fraîche.
L'effet bactéricide de l'acide acétique est que la valeur de pH modifiée empêche les processus physiologiques et dénature également les protéines.
L'acide acétique est également utilisé dans la fabrication de cosmétiques (crèmes, savons).
Sels d'acide acétique (acétates)
Les sels ou esters de l'acide acétique sont appelés acétates désigné. Ce sont principalement des sels cristallins incolores qui contiennent l'anion acétate (CH3 directeur de l'exploitation).
Des exemples d'acétates de type sel sont l'acétate de sodium (NaCH3 COO), acétate de potassium (KCH3 COO) ou acétate de plomb(II) (Pb(CH3 directeur de l'exploitation)2 ).
Les acétates de type sel sont obtenus en neutralisant l'acide acétique avec des hydroxydes métalliques ou des oxydes métalliques :
-
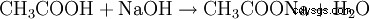
- L'acide acétique et l'hydroxyde de sodium réagissent pour former de l'acétate de sodium et de l'eau.
-
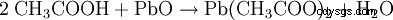
- L'acide acétique et l'oxyde de plomb(II) produisent de l'acétate de plomb et de l'eau.
En analyse chimique, les acétates peuvent être facilement détectés en broyant l'échantillon avec de l'hydrogénosulfate de potassium dans un mortier. Dans ce processus, le proton (H) de l'ion hydrogénosulfate est transféré à l'ion acétate, produisant de l'acide acétique volatil, qui peut être facilement identifié par son odeur caractéristique :
-
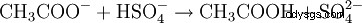
- L'acétate est protoné par l'hydrogénosulfate. De l'acide acétique et du sulfate se forment.
Les esters d'acide acétique contiennent le radical acétyle comme radical acide. Le plus connu de ces esters est l'acétate d'éthyle. Les acétates organiques sont obtenus par estérification de l'acide acétique avec des alcools (R-OH) :
-
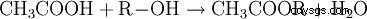
- L'acide acétique et l'alcool réagissent pour former un ester d'acide acétique et de l'eau.
Origine
- ↑ Base de données des substances BGIA GESTIS :https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 9 août 2007