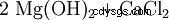| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Aucune formule structurelle disponible | |||||||
| Général | |||||||
| Nom | Hydroxyde de Magnésium | ||||||
| Autres noms | |||||||
| Formule moléculaire | Mg(OH)2 | ||||||
| Numéro CAS | 1309-42-8 | ||||||
| Brève description | poudre blanche | ||||||
| Propriétés | |||||||
| Masse molaire | 58,33 g mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 2.38g cm | ||||||
| Point de fusion | Décomposition à 350 °C | ||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| MAK | |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Hydroxyde de magnésium Mg(OH)2 est une poudre blanche amorphe. Il se produit occasionnellement dans la nature sous forme de minéral brucite. Le réseau cristallin de la brucite est constitué d'un empilement de sphères hexagonales les plus proches d'ions hydroxyde. Une couche interstitielle octaédrique sur deux est occupée par des ions magnésium (Mg).
Propriétés
L'hydroxyde de magnésium est peu soluble dans l'eau et les solutions alcalines, mais facilement soluble dans les solutions acides (par exemple l'acide chlorhydrique, l'acide nitrique). L'hydroxyde de magnésium est également facilement soluble dans les solutions de sel d'ammonium, car les ions hydroxyde sont interceptés par les ions ammonium :
-
 .
.
L'hydroxyde de magnésium forme des sels basiques et neutres avec les acides.
À des températures supérieures à 350 °C, la décomposition en oxyde de magnésium se produit lentement. A 600 °C, l'équilibre est pratiquement du côté de l'oxyde.
Obtenir et afficher
L'hydroxyde de magnésium peut être obtenu à partir de la liqueur résiduelle de l'extraction de la potasse par précipitation au lait de chaux (1) ou à partir de l'eau de mer par précipitation à la dolomie brûlée (2). Le produit est ensuite filtré et séché à environ 100°C. L'hydroxyde de magnésium particulièrement pur est créé par l'action de l'eau sur le magnésium élémentaire (3).
(1) 
(2) 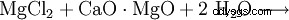
(3) 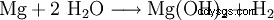
Utilisation
La majeure partie de l'hydroxyde de magnésium produit à des fins industrielles est ensuite transformée en oxyde de magnésium par calcination (cuisson) à 500-600 °C.
L'hydroxyde de magnésium est utilisé comme additif dans les huiles alimentaires (pour lier le dioxyde de soufre), comme floculant pour le traitement des eaux usées, comme retardateur de flamme dans les thermoplastiques (polyoléfines, PVC) et les élastomères, et comme additif dans les détergents.
En médecine, il est utilisé comme antiacide (médicament pour neutraliser l'acide gastrique) et comme laxatif très puissant.
L'hydroxyde de magnésium est ajouté aux aliments en tant que régulateur d'acidité ou agent de démoulage. Il est approuvé dans l'UE en tant qu'additif alimentaire avec le numéro E E 528.
Origine
- ↑ Base de données substances dangereuses BGIA Gestis