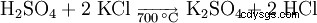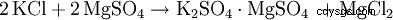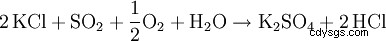| formule structurelle | |
|---|---|
| Général | |
| nom | Sulfate de potassium |
| Autres noms |
|
| Formule moléculaire | K2 SO4 |
| Numéro CAS | 7778-80-5 |
| Brève description | cristaux ou poudre incolores |
| Propriétés | |
| Masse molaire | 174,26 g/mol |
| État de la matière | corrigé |
| Densité | 2662 kg/m³ |
| Point de fusion | 1069 °C |
| Point d'ébullition | 1689 °C |
| Pression de vapeur | - |
| Solubilité | 111,1 g/l (eau à 20 °C) 250 g/l (eau à 100 °C), insoluble dans l'éthanol |
| Consignes de sécurité | |
| Symboles de danger | |
| - | |
| Phrases R et S | |
| MAK | - |
| Les unités SI sont utilisées lorsque cela est possible et courant. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |
Sulfate de potassium , formule moléculaire K2 SO4 , est le sel de potassium de l'acide sulfurique. Il est principalement utilisé comme engrais.
Historique
Le pharmacien et chimiste Johann Rudolph Glauber a été le premier à produire le sel à partir de chlorure de potassium et d'acide sulfurique, connu depuis le 14ème siècle.
Occurrences
Le sulfate de potassium se trouve dans divers minéraux sous forme de sels dits doubles. Des exemples en sont la schoénite, la léonite, la langbéinite, la polyhalite et la glasérite.
Apparence
Initialement, le sulfate de potassium était dérivé du minéral kaïnite (MgSO4 · KCl · 3H2 O) a gagné. Cependant, cette méthode de production a été rapidement abandonnée au profit de procédés plus rentables à base de chlorure de potassium.
Une possibilité dans la production de sulfate de potassium est la réaction du chlorure de potassium avec de l'acide sulfurique à une température de 700 °C.
En variante, le sulfate de potassium est à double réaction avec d'autres sulfates métalliques tels. B. Sulfate de magnésium :
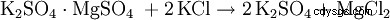
Le procédé dit Hargreaves utilise la réaction du chlorure de potassium avec un mélange de dioxyde de soufre, d'air et d'eau pour produire du sulfate de potassium :
Le sulfate de potassium est également un sous-produit de la production d'acide nitrique.
Le sulfate de potassium est plus facile à produire en faisant réagir de l'hydroxyde de potassium et de l'acide sulfurique.
Propriétés
Les cristaux anhydres sont de nature rhombique. Ils sont incolores et transparents, très durs et extrêmement stables à l'air. Le goût du sulfate de potassium est amer à salé. Bien que soluble dans l'eau, il est insoluble dans l'éthanol.
Utilisation
Le sulfate de potassium est utilisé dans la production d'alun de potasse, de verre soluble de potasse, de persulfate de potassium, de potasse, de flegmateurs, d'eau minérale, de caoutchouc synthétique et d'engrais mixtes. Il est également utilisé dans la purification de l'acide tartrique et tartrique et dans une variété d'utilisations dans les industries des colorants, des explosifs et pharmaceutiques.
Le sulfate de potassium est utilisé comme substitut du sel de table dans les aliments diététiques. C'est également un composant des engrais potassiques utilisés pour fertiliser les cultures de plantes sensibles au chlorure, par ex. B. être utilisé en viticulture.
Il porte le numéro E 515 en tant qu'additif alimentaire dans l'UE approuvé.
Le sulfate de potassium est également utilisé comme ingrédient actif dans les poudres extinctrices de classe B et C.
Origine
- ↑ Base de données des substances dangereuses BGIA Gestis
Holleman, Wiberg, Manuel de chimie inorganique , de Gruyter Verlag, 101e édition, p. 1179