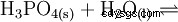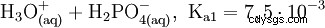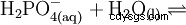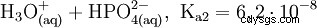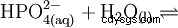| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Général | |||||||
| Nom | acide phosphorique | ||||||
| Autres noms | |||||||
| Formule moléculaire | H3 Bon de commande4 | ||||||
| Numéro CAS | 7664-38-2 | ||||||
| Brève description | solide incolore et inodore | ||||||
| Propriétés | |||||||
| Masse molaire | 98,00 g mol | ||||||
| État de la matière | solide (souvent liquide, car une masse fondue en surfusion peut être stockée pendant une longue période) | ||||||
| Densité | 1.834g cm (18°C) | ||||||
| Point de fusion | 42,35 °C | ||||||
| Point d'ébullition | Décomposition :213 °C (déshydratation) | ||||||
| Pression de vapeur | |||||||
| valeur pKa | |||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| MAK | |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
La normale ou ortho- Acide phosphorique est le principal acide du phosphore. La substance anhydre est fortement hygroscopique. C'est un acide triprotique et réagit comme un acide modérément fort par rapport à la première déprotonation. Les condensats d'acide diphosphorique, d'acides méta- et polyphosphoriques en sont dérivés. En tant qu'additif alimentaire, l'acide phosphorique est répertorié comme E 338 déclaré.
Obtenir et afficher
L'acide phosphorique peut être obtenu à partir de phosphate naturel (principalement de l'apatite, Ca5 (PO4 )3 (F, OH, Cl)) avec de l'acide sulfurique, de l'acide chlorhydrique ou de l'acide nitrique. CaSO4 sont formés comme sous-produits (anhydrite, gypse) et H2 [SiF6 ] (acide hexafluorosilicique). Alternativement, l'acide phosphorique peut être obtenu en brûlant du phosphore élémentaire pour former du pentoxyde de phosphore, P4 O10 , et hydrolyse subséquente (ce que l'on appelle l'acide phosphorique thermique).
Propriétés
L'acide phosphorique est un acide tribasique qui peut donner son hydrogène sous forme de protons solvatés en trois étapes pour former du dihydrogénophosphate, de l'hydrogénophosphate et des anions phosphate. Les valeurs pKs associées sont pKs1 =2,161 ; pKs2 =7,207 et pKs3 =12,325.
Utilisation
L'acide phosphorique est utilisé comme matière première pour la production d'engrais contenant du phosphate (> 90 % de la production aux États-Unis), de détergents, de dérouillants ou de convertisseurs de rouille et pour la passivation du fer et du zinc pour les protéger contre la corrosion. Le ciment au phosphate de zinc est utilisé en dentisterie.
Bien qu'il ait un effet caustique à fortes concentrations, il est utilisé dilué dans l'industrie alimentaire comme conservateur, acidifiant (notamment dans les boissons au cola) et comme régulateur d'acidité (E 338), car l'acide phosphorique est non toxique pour l'organisme humain. , en dehors de son effet caustique. Il convient également à la préparation de solutions tampons (différents « tampons phosphate »).
Importance biologique
Les esters d'acide phosphorique jouent un rôle central dans le métabolisme, en particulier en tant que transporteurs d'énergie et de groupe (voir par exemple ATP et GTP). Ils font partie intégrante de l'ADN, de l'ARN, de nombreux coenzymes, etc.
Preuve
L'acide phosphorique et les phosphates solubles peuvent être séparés par précipitation avec du molybdate d'ammonium pour former du phosphate de molybdate d'ammonium jaune, ou par précipitation avec des ions magnésium dans une solution ammoniacale pour former MgNH4 Bon de commande4 prouver.
Origine
- ↑ RÖMPP en ligne, Thieme 2007
- ↑ Base de données des substances BGIA GESTIS :https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 3 mars 2007
- ↑ ESIS-Système européen d'information sur les substances chimiques
- autres composés oxygénés du phosphore