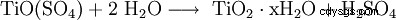| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Aucune formule structurelle disponible | |||||||
| Général | |||||||
| Nom | oxyde de titane(IV) | ||||||
| Autres noms |
| ||||||
| Formule moléculaire | O2 Ti | ||||||
| Numéro CAS | 13463-67-7 | ||||||
| Brève description | poudre cristalline blanche | ||||||
| Propriétés | |||||||
| Masse molaire | 79,90 g mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 4.24g cm | ||||||
| Point de fusion | 1855 °C | ||||||
| Point d'ébullition | 2 900 °C | ||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| Propriétés thermodynamiques | |||||||
| ΔHf | |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
oxyde de titane(IV) (Dioxyde de titane ) est l'un des oxydes de titane.
Occurrences
L'oxyde de titane(IV) se présente naturellement sous trois formes :
- Le rutile est un minéral tétragonal d'habitude principalement prismatique. Le nom rutile vient du latin rutilus – rougeâtre. Le rutile a une densité de 4,26 g/cm. Il est particulièrement apprécié comme pigment blanc.
- Anatase forme des cristaux holoédriques tétragonaux (holoédrique signifie le groupe le plus symétrique dans un système cristallin, dans le tétragonal donc 4/m 2/m 2/m). L'anatase se transforme progressivement (plus rapidement à partir d'une température supérieure à 700 °C) de manière irréversible en rutile. La densité de l'anatase est de 3,88 g/cm. L'anatase sert également de pigment blanc.
- La brookite forme des minéraux orthorhombiques et ne sert pas de pigment blanc. La brookite se transforme également en rutile en dessous du point de fusion.
Depuis les dépôts naturels ont des couleurs inquiétantes qui z. B. par le fer dans l'ilménite (FeTiO3 ) sont causés, ceux-ci sont raffinés dans le procédé au sulfate ou le procédé au chlorure (préféré).
Obtenir et afficher
Par solvolyse (hydrolyse) du composé Ti(IV) :
Propriétés
Le point de fusion du dioxyde de titane est de 1855 °C. Il est thermiquement stable, durable, a un indice de réfraction élevé (2,8) et donc un grand pouvoir colorant et couvrant. Le dioxyde de titane est chimiquement très inerte. Il est résistant à la lumière, peu coûteux, totalement non toxique et donc le pigment blanc le plus important.
Utilisation
Le dioxyde de titane est utilisé comme colorant blanc. Il a été découvert en Norvège et aux États-Unis en 1908 et y a été fabriqué à partir de 1909 sous le nom de Kronos Titanium White. La production a commencé en Allemagne en 1924 sous le nom de Degea-Titanweiß. Le blanc de titane n'a été produit que sous la forme anatase jusqu'en 1938, mais ensuite principalement sous la forme rutile, qui s'est avérée plus stable aux liants pétroliers et aux colorants organiques. C'est pourquoi on l'appelait aussi blanc de rutile.
Le blanc de titane a la plus grande opacité de tous les pigments blancs et un excellent pouvoir éclaircissant. Il est chimiquement stable, non toxique et peut être trouvé sous la désignation E 171 comme additif alimentaire dans les dentifrices et les pastilles contre la toux, par exemple. Il est aussi parfois utilisé dans la peinture à l'huile. Dans le domaine technique, il est utilisé dans les peintures et les vernis (par exemple pour la peinture murale et les textiles), dans le papier et comme bloqueur d'UV dans les crèmes solaires et les azurants dans les médicaments (comprimés). L'effet photocatalytique du TiO2 Les nanoparticules sont utilisées en lien avec l'activité UV pour les surfaces « autonettoyantes » (autonettoyage photocatalytique). La cellule solaire à colorant (cellule Grätzel) est à nouveau basée sur les propriétés semi-conductrices du dioxyde de titane. Le dioxyde de titane est également utilisé comme composant principal du diélectrique céramique dans les condensateurs céramiques de classe 1.
Le dioxyde de titane dans la modification anatase est le composant principal des catalyseurs utilisés pour la dénitrification industrielle des gaz de combustion à l'aide du procédé SCR.
La production d'oxyde de titane par le procédé au sulfate produit de l'acide dilué (acide sulfurique dilué), dont une partie est réutilisée pour la production d'oxyde de titane par concentration. Dans certains pays, une partie de cet acide dilué est encore rejetée ou déversée dans les rivières et les mers. Le procédé au chlorure, en revanche, ne produit pas d'acide dilué. Le chlore utilisé reste en grande partie dans le cycle du procédé.
TiO2 est également utilisé dans le domaine de la finition des carreaux, ce qui signifie que les surfaces des carreaux traités deviennent anti-salissures.
Preuve
Le dioxyde de titane fraîchement précipité à froid est amphotère et soluble dans les acides minéraux dilués. La digestion a lieu avec de l'hydrogénosulfate de potassium dans un creuset en porcelaine. Il est ensuite dissous dans de l'eau froide avec un peu d'acide sulfurique. Avec quelques gouttes d'eau oxygénée, le [Ti(O2) jaune (basique) à jaune-orangé (acide, photo) ) aq] cation L'acide chlorhydrique et le zinc (granulés) forment de l'hydrogène naissant, qui transforme Ti(IV) en rouge-violet [Ti(H2 O)6 ] réduit.
Nanotechnologie
Preuves individuelles
- ↑ Entrée sur l'oxyde de titane(IV) dans la base de données des substances GESTIS du BGIA, récupérée le 29 novembre 2007 (JavaScript requis)
- ↑ Susanne Donner :Nettoyer avec le pouvoir de la lumière . Technology Review, n° 7, juillet 2006, pp. 19ff.