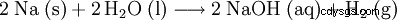| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| General | |||||||
| Nombre | Hidróxido de Sodio | ||||||
| Otros nombres | Sosa cáustica, soda cáustica, soda cáustica, esteatita, hidróxido de sodio, hidróxido de sodio, soda cáustica (solución acuosa), E 524 | ||||||
| Fórmula molecular | NaOH | ||||||
| Número CAS | 1310-73-2 | ||||||
| Breve descripción | sólido cristalino blanco, a menudo en forma de gránulos | ||||||
| Propiedades | |||||||
| Masa molar | 39,997 g mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 2.130 g cm | ||||||
| Punto de fusión | 322 °C | ||||||
| Punto de ebullición | 1388°C | ||||||
| Presión de vapor | 13 Pa (618 °C) | ||||||
| Solubilidad |
Fácilmente soluble en agua: | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| MAC | no especificado | ||||||
| WGK | 1:ligeramente peligroso para el agua | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Hidróxido de sodio (también sosa cáustica , sosa cáustica ), fórmula química NaOH , es un sólido higroscópico blanco. Se disuelve en agua generando grandes cantidades de calor para dar sosa cáustica fuertemente alcalina (pH aprox. 14 a c =1 mol/l). Reacciona con el dióxido de carbono del aire para formar carbonato de sodio y, por lo tanto, se almacena en recipientes herméticos. Para evitar que el hidróxido de sodio se una al agua del aire, puede almacenarse junto con un desecante. Como base fuerte, desplaza a las bases más débiles y volátiles de sus sales.
La producción mundial en 2001 fue de 46 millones de toneladas.
Fabricación
- Reacción de carbonato de sodio con hidróxido de calcio para formar hidróxido de sodio y carbonato de calcio:
El carbonato cálcico poco soluble se filtra. El hidróxido de sodio fácilmente soluble permanece en el filtrado.
- Electrólisis de cloruro de sodio a sosa cáustica, hidrógeno y cloro gaseoso (electrólisis de cloro-álcali).
Hay varios procesos industriales:
- Procedimiento de amalgama
- Procedimiento de diafragma
- proceso de membrana
(ver también electrólisis cloro-álcali)
Todos los procesos tienen en común pasos adicionales de purificación y concentración para llegar al hidróxido de sodio anhidro.
- El hidróxido de sodio se puede obtener en el laboratorio haciendo reaccionar sodio elemental con agua para formar sosa cáustica e hidrógeno:
- Una vez evaporada la soda cáustica, queda hidróxido de sodio sólido:
Uso
- Producción de varios jabones (sosa cáustica)
- Producción de colorantes (sosa cáustica)
- Producción de celulosa a partir de madera y paja
- Algodón mercerizado
- Limpieza de grasas, aceites y derivados del petróleo
- Digestión de bauxita (precursor en la producción de aluminio)
- Síntesis de varios productos químicos (por ejemplo, hipoclorito de sodio, fosfato de sodio, sulfuro de sodio, aluminato de sodio)
- Síntesis de ácido fórmico
- Producción de agua desmineralizada:regeneración de intercambiadores de iones
- Revelado de material de placa de circuito impreso expuesto en electrónica (aprox. 10 g/l a 20 °C)
- Parte de los limpiadores de desagües
- Hacer pretzels para el color marrón y el sabor "jabonoso"
- Regeneración de desionizadores para necesidades de laboratorio y acuario
- Grabado de planchas de latón, alpaca y cobre para el maquetista
- Determinación de la acidez del vino con lejía azul
- Limpieza de tanques de acero inoxidable
- Eliminación de pintura vieja (decapado)
- Para alisar el cabello encrespado (relajante)
- Locomotora Natrón
- Detección de todos los compuestos orgánicos de nitrógeno ("Detección manual")
- Eliminación de la piel de frutas y verduras (!) durante el procesamiento industrial
- enfriar disuelto en agua para endurecer el acero
Ejemplo experimental
Si agrega un poco de hidróxido de sodio al agua y luego la remueve, la solución se calentará. Esto es adecuado como ejemplo simple de un proceso de solución exotérmica que se usa en la escuela, por ejemplo. El efecto contrario, un proceso de disolución endotérmica, se puede observar al disolver nitrato de potasio o nitrato de amonio en agua, siendo el efecto mucho más fuerte al disolver nitrato de amonio (disminución de la temperatura de aproximadamente 10 K).
Fuentes
- ↑ Base de datos de sustancias de BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 15 de febrero de 2007
- Sodio