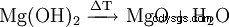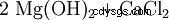| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Ingen strukturformel tillgänglig | |||||||
| Allmänt | |||||||
| Namn | Magnesiumhydroxid | ||||||
| Andra namn | Magnesium(II)hydroxid, brucit, E528 | ||||||
| Molekylformel | Mg(OH)2 | ||||||
| CAS-nummer | 1309-42-8 | ||||||
| Kort beskrivning | vitt pulver | ||||||
| Egenskaper | |||||||
| Molarmassa | 58,33 g mol | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 2,38 g cm | ||||||
| Smältpunkt | 350 °C sönderdelning | ||||||
| Löslighet | inte i vatten och alkohol, bra i ammoniumsaltlösningar och utspädda syror (L=1 10 moll; i vatten vid 25°C) | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| MAK | inte inställt | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Magnesiumhydroxid Mg(OH)2 är ett amorft vitt pulver. Det förekommer ibland i naturen som mineralet brucit. Kristallgittret av brucit består av en hexagonal närmast sfärisk packning av hydroxidjoner. Vartannat oktaedriskt gapskikt upptas av magnesiumjoner (Mg).
Egenskaper
Magnesiumhydroxid är svårlösligt i vatten och alkaliska lösningar, men lättlösligt i sura lösningar (t.ex. saltsyra, salpetersyra). Magnesiumhydroxid är också lättlöslig i ammoniumsaltlösningar, eftersom hydroxidjonerna fångas upp av ammoniumjonerna:
-
 .
.
Magnesiumhydroxid bildar basiska och neutrala salter med syror.
Vid temperaturer över 350 °C sker långsamt nedbrytning till magnesiumoxid. Vid 600 °C är jämvikten praktiskt taget på oxidsidan.
Erhålla och visa
Magnesiumhydroxid kan erhållas från restlut från kaliumutvinning genom utfällning med kalkmjölk (1) eller från havsvatten genom utfällning med bränd dolomit (2). Produkten filtreras sedan och torkas vid cirka 100°C. Särskilt ren magnesiumhydroxid skapas genom inverkan av vatten på elementärt magnesium (3).
(1) 
(2) 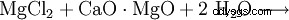
(3) 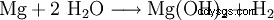
Användning
Det mesta av magnesiumhydroxiden som produceras för industriella ändamål bearbetas vidare till magnesiumoxid genom kalcinering (bränning) vid 500–600 °C.
Magnesiumhydroxid används som en ätbar oljetillsats (för att binda svaveldioxid), som ett flockningsmedel för rening av avloppsvatten, som ett flamskyddsmedel i termoplaster (polyolefiner, PVC) och elastomerer, och som tillsats i tvättmedel.
Inom medicinen används det som antacida (läkemedel för att neutralisera magsyra) och som ett mycket starkt laxermedel.
Magnesiumhydroxid tillsätts livsmedel som surhetsreglerande medel eller släppmedel. Den är godkänd i EU som livsmedelstillsats med E-numret E 528.
Källor
- ↑ BGIA Gestis databas för farliga ämnen