| strukturformel | ||||||||
|---|---|---|---|---|---|---|---|---|
| Ingen strukturformel tillgänglig | ||||||||
| Allmänt | ||||||||
| Namn | ammoniumhydroxid | |||||||
| Andra namn | Ammoniaklösning, vatten, lut, frätande ammoniak, frätande ammoniak, ammoniaklösning, staghornssprit, frätande ammoniak, ammoniumhydrat | |||||||
| Molekylformel | NH4 Åh | |||||||
| CAS-nummer | 1336-21-6 | |||||||
| Kort beskrivning | färglös stickande vätska | |||||||
| Egenskaper | ||||||||
| Molarmassa | 35,1 g mol | |||||||
| Sakens tillstånd | flytande | |||||||
| Densitet | 0,91 g cm (25 %) 0,88 g cm (32 %) | |||||||
| Smältpunkt | −57,5 °C (25 %) −91,5 °C (32 %) | |||||||
| Kokpunkt | 37,7 °C (25 %) 24,7 °C (32 %) | |||||||
| Ångtryck |
483 hPa (25 %) | |||||||
| Löslighet | helt blandbar med vatten | |||||||
| Säkerhetsinstruktioner | ||||||||
| ||||||||
| MAK | 20 ml m; 14 mg m | |||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | ||||||||
Ammoniumhydroxid , även ammoniaklösning eller ammoniakvatten , på laboratoriespråk också endast z. B. 25 % ammoniak kallas, är i första hand en fysisk lösning av ammoniak (NH3 ) i vatten (H2 O), där partiell protolys sker från vatten till ammoniak, och som därför är basisk. Namnet ammoniumhydroxid antyder att det är ett isolerbart ämne, men det är inte möjligt. Därför är denna beteckning faktiskt inte helt korrekt, men används ändå eftersom den kännetecknar ämnets beteende.I den högsta koncentrationen har ammoniakvatten en densitet på 0,880 g/cm³ (=32 % ≙ 620 l NH3 i 1L H2 O).
Livsmedelstillsatsens märkning är E 527.
Genesis
Om ammoniak (NH3 ) i vatten (H2 O) är löst, ammoniakmolekyler (som är inbyggda i det polymera vätebindningssystemet vatten och därför är fysiskt lösta) fångar upp individuella protoner som produceras av vattnets autoprotolys:
-
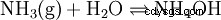 .
.
De flesta av de nybildade molekylerna reagerar tillbaka, så det mesta av den lösta ammoniaken finns kvar som NH3 , och inte som NH4 finns.
Egenskaper
Ammoniumhydroxidlösningar innehåller i allmänhet en betydande andel ammoniak, som fysiskt löst, d.v.s. blandat med vattnet, avdunstar på samma sätt som vatten gör, på grund av det högre ångtrycket också mycket snabbare, varför ammoniakkoncentrationen i öppna kärl minskar med tiden. Den typiska, stickande, lakritsliknande lukten av ammoniak uppstår. B. analogt från konc. saltsyra avdunstar och bildar en tät vit rök av ammoniumklorid i en icke-vattenhaltig syra-bas-reaktion.
I lågtemperaturexperiment, en additionsförening (NH3 H2 O) kan isoleras, som smälter vid -77 °C. Detta är dock inte den faktiska ammoniumhydroxiden, utan snarare ammoniakkristaller med vidhängande vatten.
Säkerhetsinstruktioner
Märkningsdata i tabellen avser den koncentrerade lösningen (=32%) EU har definierat följande klassificeringar för andra koncentrationsintervall:
| C ≥ 25 % | C,N | R:34-50 |
| 10 % ≤ C <25 % | C | R:34 |
| 5 % ≤ C <10 % | Xi | R:36/37/38 |
Historik
Salmiak sägs ha varit känd för de gamla egyptierna och postulerades först av Arrhenius för hans framgång med att beskriva baser.
Användning
Flytande ammoniak används som huskur för rengöring av ytor i hushållet, men är också ett insidertips för att stöta bort getingar. För detta ändamål läggs lite ammoniakvätska i en liten skål i slutna rum, getingar kommer att undvika rummet från och med nu på grund av lukten. Utanför en byggnad, ta pappershanddukar indränkta i ammoniak och sprid ut dem nära getingboet.
Det rekommenderas också att använda det för att rengöra och bekämpa mild till måttlig mögeltillväxt på väggar.
Ett annat användningsområde är bekämpning av skadedjur som silverfisk.
Faror
Ammoniumhydroxidlösningar som innehåller mer än 10 % ammoniak är frätande. Långvarig inandning kan orsaka impotens, t.ex. B. i tobaksrök från cigaretter.
Att svälja ammoniakvatten orsakar svår smärta, magkatarr, blodiga kräkningar, lung- och röstskador, som ofta har en dödlig utgång. Det angriper också ögonen.
Eftersom ammoniak är den primära förångningsprodukten, gäller farorna med detta ämne även ammoniakångor.


