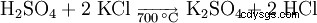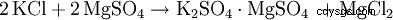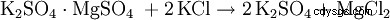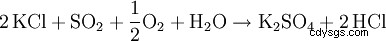| strukturformel | |
|---|---|
| Allmänt | |
| namn | Kaliumsulfat |
| Andra namn |
|
| Molekylformel | K2 SO4 |
| CAS-nummer | 7778-80-5 |
| Kort beskrivning | färglösa kristaller eller pulver |
| Egenskaper | |
| Molar massa | 174,26 g/mol |
| Sakens tillstånd | fixat |
| Densitet | 2662 kg/m³ |
| Smältpunkt | 1069 °C |
| Kokpunkt | 1689 °C |
| Ångtryck | - |
| Löslighet | 111,1 g/l (vatten vid 20 °C) 250 g/l (vatten vid 100 °C), olösligt i etanol |
| Säkerhetsinstruktioner | |
| Farosymboler | |
| - | |
| R- och S-fraser |
R:inga riskfraser |
| MAK | - |
| SI-enheter används där det är möjligt och vanligt. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |
Kaliumsulfat , molekylformel K2 SO4 , är kaliumsaltet av svavelsyra. Det används främst som gödningsmedel.
Historik
Apotekaren och kemisten Johann Rudolph Glauber var den första som tillverkade saltet av kaliumklorid och svavelsyra, som har varit känt sedan 1300-talet.
Förekomster
Kaliumsulfat finns i olika mineraler i form av så kallade dubbelsalter. Exempel på detta är schoenit, leonit, langbeinit, polyhalit och glaserit.
Utseende
Till en början härleddes kaliumsulfat från mineralet kainit (MgSO4 · KCl · 3 H2 O) vann. Denna produktionsmetod övergavs dock snart till förmån för mer kostnadseffektiva processer baserade på kaliumklorid.
En möjlighet vid framställning av kaliumsulfat är reaktionen av kaliumklorid med svavelsyra vid en temperatur av 700 °C.
Alternativt är kaliumsulfat dubbelreaktion med andra metallsulfater såsom. B. Magnesiumsulfat:
Den så kallade Hargreaves-processen använder reaktionen av kaliumklorid med en blandning av svaveldioxid, luft och vatten för att producera kaliumsulfat:
Kaliumsulfat är också en biprodukt av produktionen av salpetersyra.
Kaliumsulfat är lättare att producera genom att reagera kaliumhydroxid och svavelsyra.
Egenskaper
De vattenfria kristallerna är rombiska till sin natur. De är färglösa och genomskinliga, mycket hårda och extremt stabila i luft. Smaken av kaliumsulfat är bitter till salt. Även om den är löslig i vatten, är den olöslig i etanol.
Användning
Kaliumsulfat används vid framställning av kaliumalun, kalivattenglas, kaliumpersulfat, kaliumklorid, flegmatorer, mineralvatten, syntetiskt gummi och blandade gödselmedel. Det används också vid rening av vin- och vinsyra och i en mängd olika användningsområden inom färgämnes-, sprängämnes- och läkemedelsindustrin.
Kaliumsulfat används som ersättning för bordssalt i dietmat. Det är också en komponent i kaliumgödsel som används för att gödsla kloridkänsliga växtkulturer, t.ex. B. användas i vinodling.
Den har numret E 515 som livsmedelstillsats i EU godkänd.
Kaliumsulfat används också som aktiv ingrediens i klass B och C släckningspulver.
Källor
- ↑ BGIA Gestis databas för farliga ämnen
Holleman, Wiberg, Textbook of Inorganic Chemistry , deGruyter Verlag, 101:a upplagan, s. 1179