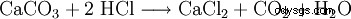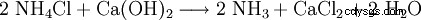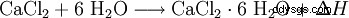| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Ingen strukturformel tillgänglig | |||||||
| Allmänt | |||||||
| Namn | Kalciumklorid | ||||||
| Andra namn |
| ||||||
| Molekylformel | CaCl2 | ||||||
| CAS-nummer | 10043-52-4 (vattenfri) 10035-04-8 (dihydrat) 25094-02-4 (tetrahydrat) 07774-34-7 (hexahydrat) | ||||||
| Kort beskrivning | färglösa och luktfria, hygroskopiska kristaller | ||||||
| Egenskaper | |||||||
| Molarmassa | 110,98 g mol (vattenfri) 147,02 g mol (dihydrat) 182,04 g mol (tetrahydrat) 219,08 g mol (hexahydrat) | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 2,16 g cm (vattenfri) 1,85 g cm (dihydrat) 1,71 g cm (hexahydrat) | ||||||
| Smältpunkt | 782 °C (vattenfri) ca. 176 °C (dihydrat) ca. 35 °C (tetrahydrat) | ||||||
| Kokpunkt | 1935 °C | ||||||
| Ångtryck | 11 hPa | ||||||
| Löslighet |
lättlöslig i vatten:740 g l (20 °C) | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
| Kristallstruktur ||Rutil (förvrängd), oktaedriskkalciumklorid (även kalciumklorid ) är en klorid av jordalkalimetallen kalcium med molekylformeln CaCl2 . Kalcium har oxidationstillståndet +2, klor har oxidationstillståndet −1.
Historik
Omkring 1860 lyckades kemisterna Robert Wilhelm Bunsen och Matthiessen med den första rena framställningen av grundämnet kalcium genom elektrolys av kalciumklorid.
Förekomster
Kalciumklorid förekommer i naturen löst i saltlake.
Erhålla och visa
Kalciumklorid tillverkas av saltsyra och kalciumkarbonat:
Efterföljande uppvärmning till 260 °C ger den vattenfria formen.
Tekniskt sett erhålls kalciumklorid som en restprodukt från produktionen av soda med Solvay-processen, nämligen när ammoniaken återvinns från den ammoniumklorid som produceras:
Egenskaper
Kalciumklorid är ett salt. Kalcium och klor finns som joner på grund av den stora skillnaden i elektronegativitet. Bindningen sker alltså via elektrostatiska interaktioner.
I sin rena form bildar kalciumklorid färglösa kristaller och är mycket hygroskopisk när den är vattenfri. Den absorberar lätt vatten från omgivningen och bildar ett hydratkomplex.
Reaktioner
Kalciumklorid reagerar med vatten och bildar ett hexahydratkomplex och utvecklar mycket värme (exoterm, ΔH> 0):
Hexahydratets kristaller löser sig i sitt eget kristallisationsvatten vid cirka 30 °C. Det bundna vattnet frigörs igen genom uppvärmning till cirka 200 °C. Upplösning i vatten leder, till skillnad från vattenfri kalciumklorid, till en kraftig kylning. Båda formerna av kalciumklorid är också lättlösliga i etanol.
Användning
På grund av sin hygroskopi är vattenfri kalciumklorid ett viktigt torkmedel i laboratoriet, till exempel i exsickatorn, och i teknisk kemi för en mängd olika gaser och vätskor. Användningsområden är torkning av bostadsutrymmen, användning som frostskyddsmedel, särskilt som frostskyddsmedel och härdningsaccelerator i betong, och som dammbindemedel (t.ex. på byggarbetsplatser). Inom medicinen används det för att stoppa blödningar och för att behandla kalciumbristsjukdomar, samt för att behandla köldskador och allergier.
Den används som uppstramande, smakförstärkare och stabilisator (t.ex. vid behandling av dricksvatten, ytbehandling av frukt). I EU är den numrerad E 509 som en livsmedelstillsats godkänd.
Kalciumklorid används för att värma upp drickfärdiga drycker genom att använda exotermisk hydrering när den reagerar med vatten. Den används även som vägsalt och för framställning av kylblandningar (se ovan ).
Det används också för att koagulera proteiner inom livsmedelsteknik och används vid tillverkning av produkter som tofu eller konstgjord kaviar.
Källor
- ↑ BGIA GESTIS ämnesdatabas:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 9 maj. 2007