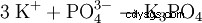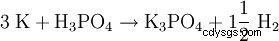| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| 3 K | |||||||
| Allmänt | |||||||
| Namn | Kaliumfosfat | ||||||
| Andra namn | trikaliumfosfat | ||||||
| Molekylformel | K3 PO4 | ||||||
| CAS-nummer | 7778-53-2 | ||||||
| Egenskaper | |||||||
| Molarmassa | 212,28 g mol | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 2,56 kg m | ||||||
| Smältpunkt | 1340 °C | ||||||
| Löslighet | löslig i vatten | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Kaliumfosfat är kaliumsaltet av fosforsyra.
Erhållande/representation
Kaliumfosfat bildas också när Thomas slagg värms upp med kol och kaliumsulfat.
Egenskaper
Kaliumfosfat löses i vatten med en alkalisk reaktion.
Tillverkning:
Användning
Fosfater används som tillsatser i tvättmedel och kan reducera vattnets hårdhet genom att bilda komplex med flervärda metalljoner (Mg etc.). Deras användning är nu förbjuden i vissa länder (inklusive Schweiz).
Fosfater används också som konstgödsel.
Biologisk betydelse
Konsekvensen av dess användning i tvättmedel är en större tillgång på näringsämnen i vattendrag. Detta resulterar i ökad algtillväxt, vilket kan leda till att en vattenmassa välter.
Kaliumfosfat är känt inom homeopati som ett nervgift.